Содержание
Миксоматоз кроликов | ЕвроВЕТ
Миксоматоз (лат. — Mixomatosis cuniculi; англ. — Infectious myxoma of rabbits) — острое высококонтагиозное вирусное заболевание кроликов, характеризующееся серозно-гнойным конъюнктивитом и образованием студенистых отеков в области головы, ануса и наружных половых органов.
Заболевание впервые зарегистрировано в 1898 г. в Уругвае. И уже до конца 1980-х годов болезнь, наносящую огромный экономический ущерб кролиководческим хозяйствам, стали регистрировать практически во всех странах мира. На территории Украины инфекция проявилась в 1989 г.
Возбудитель (Myxoma leporipoxvirus) — ДНК-содержащий вирус из рода Leporipoxvirus семейства Poxviridae.
Вирус чувствителен к действию трипсина, полностью инактивируется эфиром, устойчив к высушиванию. Прогревание вируса в течении часа при температуре 56°С инактивирует его. При отрицательных температурах вирус сохраняет инфекционность многие месяцы. В трупах животных, погибших от миксоматоза, возбудитель сохраняется до 7 дней, в высушенных шкурках — до 10 месяцев, в почве — до 2 лет.
Миксоматозом болеют домашние и дикие кролики независимо от возраста. Миксоматоз распространяется кровососущими насекомыми (москитами, комарами, мошками, кусающими мухами, клещами и т.п.), в организме которых вирус сохраняется до 7 мес., создавая резервуар возбудителя. При этом крайне редко может передаваться при прямом контакте между кроликами.
Для миксоматоза характерна сезонность. Это связано с лётом комаров и других членистоногих. К концу лета — началу осени болезнь достигает стадии максимального подъема, а затем наступает резкий спад. Возможны также случаи возникновения заболевания в зимний период. (вследствие климатических аномалий в виде теплых зим, когда температура воздуха способствует активности и размножению насекомых).
(вследствие климатических аномалий в виде теплых зим, когда температура воздуха способствует активности и размножению насекомых).
После первичного размножения, чаще всего в слизистых оболочках ротовой и носовой полостей, вирус проникает лимфоидным путем в регионарные лимфоузлы, где через 48 ч начинается вторая стадия размножения. Уже на 3-4 день появляется виремия и развиваются патологические изменения, при этом нарушается проницаемость капилляров, возникают отеки. Наибольшее количество вируса выявлено в миксомах, затем в лимфоузлах, легких, селезенке и крови, во всех внутренних органах и кожных поражениях больных и переболевших кроликов. Через 3 дня после инфицирования вирус выделяется с секретами носовой полости и глаз, на 4-е сутки обнаруживается также в коже и семенниках, на 5-е сутки — в области наружных половых органов.
Инкубационный период при миксоматозе длится от 2 до 20 дней, что зависит от вирулентности, способа заражения и устойчивости организма.
Миксоматоз может иметь острое и подострое течение.
Острое течение болезни, охватывает до 95-100% поголовья и сопровождается высокой смертностью. При подостром течении наблюдают воспалительные псевдоопухолевые изменения и смертность также высокая.
Болезнь может протекать в 2 — х клинических формах:
- Классической, характеризующейся появлением студенистых отеков на теле;
- Нодулярной (узелковой), при которой на теле появляются ограниченные опухоли.
Классическая форма болезни более опасна, смертность при ней достигает 100%. Нодулярная форма сопровождается более доброкачественным течением, но смертность также высокая — 70-90%.
При обеих формах болезни первыми признаками являются: покраснения в виде пятен или маленьких бугорков на коже кроликов, в основном в области век и на ушных раковинах. При остром течении болезнь (это чаще бывает при классической форме) длится 5-6 дней. У кролика распухшая голова, распухшие и опущенные уши.
При более длительном течении болезни появляется конъюнктивит, веки набухают, краснеют, из глаз выделяется гнойнофибринозный экссудат. Из носовой полости выделяются гнойные истечения, которые засыхают вокруг носовых ходов в виде корочек. Дыхание становится затрудненным.
Из носовой полости выделяются гнойные истечения, которые засыхают вокруг носовых ходов в виде корочек. Дыхание становится затрудненным.
Нодулярная (узелковая) форма болезни протекает легче. Папулы, узелки величиной от просяного зерна до голубиного яйца образуются на различных участках тела. На 10-14 день на месте узелковых разрастаний формируются очаги некроза. Болезнь может продолжаться до 30-40 дней.
При классической форме температура тела у кроликов за сутки до появления признаков болезни поднимается до 40°С, но затем падает до нормы. При узелковой форме она, как правило, остается в пределах нормы (38,5-39,5°С).
В хозяйствах промышленного типа зарегистрирована особая клиническая форма миксоматоза, характеризующаяся поражением органов дыхания, насморком, слезотечением. Иногда болезнь сопровождается нарушением воспроизводства и гибелью крольчат. При вскрытии трупов наблюдаются студенистые инфильтраты в подкожной клетчатке туловища, шеи, головы и конечностей. В случаях длительного течения болезни отмечаются кровоизлияния в легочную ткань, очаговая бронхопневмония. В остальных органах не обнаруживают каких-либо характерных изменений.
В случаях длительного течения болезни отмечаются кровоизлияния в легочную ткань, очаговая бронхопневмония. В остальных органах не обнаруживают каких-либо характерных изменений.
При патологоанатомическом вскрытии в подкожной соединительной ткани головы, шеи, гениталий и конечностей обнаруживают скопление желтоватой, тянущейся, почти прозрачной студенистой жидкости, которая содержит большое количество эозинофильных гранулоцитов и гистиоцитарных клеток, частично находящихся в стадии деления (т.н. миксомных клеток). Помимо инфильтратов характерны гиперемия и увеличение лимфатических узлов и селезенки. Также устанавливают катаральную пневмонию или бронхопневмонию и острое воспаление слизистых оболочек.
Диагноз ставят на основании эпизоотологических данных, характерной клинической картины, патологоанатомических изменений и результатов лабораторных исследований. Лабораторная диагностика заключается в постановке биологической пробы на кроликах и гистологическом анализе патологоанатомического материала.
Дифференциальный диагноз: сходные с миксоматозом клинические признаки может носить оспа кроликов. У кролика, переболевшего оспой, внутренние органы изменены — сердечная мышца дряблая, печень не розового, а темно-вишневого цвета (иногда с желтушным оттенком), селезенка несколько, увеличена, сине-фиолетового цвета.
Миксоматоз необходимо также дифференцировать от стафилококкоза и бродячей пиемии с подкожными абсцессами. Последние, в отличие от миксоматозных абсцессов, содержат густой белый гнойный экссудат. Кроме того, при бродячей пиемии отсутствуют поражения головы, глаз и аногенитальной области.
Лечения НЕТ!!!!
Профилактика миксоматоза включает в себя проведение общих ветеринарно-санитарных мероприятий и специфическую профилактику заболевания.
Общие ветеринарно-санитарные мероприятия включают охранно-ограничительные меры при перемещениях животных и сырья, профилактическое карантинирование вновь поступивших животных, полноценное и рациональное кормление, своевременное выделение больных и их изоляцию, обезвреживание и утилизацию навоза и трупов животных, регулярное проведение дезакаризации и дезинсекции, регулярную очистку и дезинфекцию помещения, инвентаря и территорий.
Одним из самых надежных дезинфектантов в отношении вируса миксомы является препарат Бромосепт-50 (ABIC Biological Laboratorses Ltd. (Израиль)).
Для расчета концентрации рабочих растворов Бромосепт-50 принимают за 100 % вещество. Рабочие растворы готовят в емкостях из любого материала, путем разведения препарата в воде в соответствии с расчетами, приведенными в табл. 1.
Количество Бромосепта 50 и воды, необходимых для приготовления рабочих растворов.
Табл.1
| Концентрация препарата, % | 1 л рабочего раствора | 10 л рабочего раствора | ||
| Препарат (мл) | Вода (мл) | Препарат (мл) | Вода (мл) | |
| 0,05 | 0,5 | 999,5 | 5 | 9995 |
| 0,07 | 0,7 | 999,3 | 7 | 9993 |
| 0,08 | 0,8 | 999,2 | 8 | 9992 |
| 0,1 | 1 | 999 | 10 | 9990 |
| 0,2 | 2 | 998 | 20 | 9980 |
| 0,5 | 5 | 995 | 50 | 9950 |
Для профилактической дезинфекции оборудования и инвентаря используют 0,05% раствор Бромосепта-50, а для вынужденной дезинфекции — 0,1%-ный раствор. Обработку элементов оборудования из неокрашенного дерева проводят дважды с интервалом 15-20 мин. Общая экспозиция во всех случаях составляет 3 часа.
Обработку элементов оборудования из неокрашенного дерева проводят дважды с интервалом 15-20 мин. Общая экспозиция во всех случаях составляет 3 часа.
Дезинфекцию помещений проводят при температуре воздуха от 0 до 30°С (оптимальная 18-20°С), при температуре воздуха выше 30°С норму расхода препарата следует увеличить на 25%.
Во всех случаях по окончании экспозиции кормушки, поилки и поверхности оборудования, которые контактируют с животными, кормами, сырьем и продукцией, тщательно моют водой. С остальных поверхностей смывать препарат нет необходимости.
Также, Бромосепт-50 используют для санации и дезинфекции систем водопоения в концентрации 0,01%.
Регулярная вакцинация животных является основой специфической профилактики миксоматоза кроликов.
На территории Украины зарегистрирован ряд вакцин для профилактики данного заболевания. Наиболее эффективными среди них являются:
— Миксорен (Мухоrеn) — живая вакцина против миксоматоза кроликов (Bioveta a. s., Чехия)
s., Чехия)
— Песторин Мормикс (Pestorin Моrmух) — вакцина против вирусной геморрагической болезни и миксоматоза кроликов (Bioveta a.s.,Чехия).
Применение указанных вакцин создает стойкий иммунитет и обеспечивает защиту поголовья кроликов от заражения миксоматозом.
Вакцина Мухоrеn получена из штамма CAMP V-219 и индуцирует устойчивый иммунитет продолжительностью до 6 мес. Вакцину вводят в объеме 1 мл, подкожно. (табл. 2)
Вакцина Мухоrеn комплектуется оригинальным растворителем, который обеспечивает отличную растворимость препарата, поддерживает ее высокие иммуногенные качества и стабильность при введении.
Вакцина Pestorin Моrmух стимулирует развитие активного иммунитета против вирусной геморрагической болезни и миксоматоза кроликов.
Устойчивый иммунитет против вирусной геморрагической болезни развивается через 10 дней после вакцинации и продолжается на протяжении 1 года, против миксоматоза — 6 месяцев. Вакцину вводят в объеме 1 мл, подкожно.
Рекомендуемые схемы вакцинации против миксоматоза кроликов.
Табл.2
| Возраст кроликов | Стабильная эпизоотическая ситуация | Нестабильная эпизоотическая ситуация | |
| 4 недели | Мухоrеn | ||
| 6 недель | Pestorin Моrmух | ||
| 10 недель | Мухоrеn | Мухоrеn или Pestorin Моrmух | Pestorin Моrmух |
Вакцинация против миксоматоза не должна проводиться, если кролику еще нет 4 недель. Нельзя вакцинировать сукрольных крольчих во второй половине беременности. Вакцинируют только здоровых животных.
В комплексе мероприятий по профилактике инфекционных болезней кроликов используют так же вакцины Песторин (Рestorin) — инактивированная вакцина против вирусной геморрагической болезни кроликов штамм 1 (RHDV1), Песторин 2 (Рestorin 2) — инактивированная вакцина против вирусной геморрагической болезни кроликов штамм 2 (RHDV2) и Пазорин-Ол (Pasorin—Ol) — вакцина против пастереллеза кроликов, произведенные компанией Вioveta a. s. (Чехия).
s. (Чехия).
Список литературы:
- Самуйленко А. Я., Соловьева Б. В., Непоклонова Е. А., Воронина Е. С.. Инфекционная патология животных. М. «Академкнига», 2006. — 1911 с.
- Сюрин В. Н., Самуйленко А. Я., Соловьев Б. В., Фомина Н. В. Вирусные болезни животных. Москва, ВНИТИБП, 1998. — 928 с.
- Шевченко А.А., Шевченко Л.В. Вирусные болезни кроликов. Москва «Аквариум», 2007.-78с.
- Бондаренко С.П., Содержание кроликов пуховых пород. М.: ООО «Издательство АСТ»; Донецк: «Сталкер», 2003. — 219с.
- Мирось В.В., Калмыков К.В., Зайцев А.Г. Справочник кроликовода и зверовода. 2- е изд. доп. и перераб. К., «Урожай», 1980, 176с.
Горизонтальная трансмиссивная защита от миксоматоза и геморрагической болезни кроликов с помощью рекомбинантного вируса миксомы
1. Аргуэлло Дж. Л. Вклад в профилактику миксоматоза срединного использования в качестве гомолога. Мед Вет. 1986; 3: 91–103. [Google Scholar]
2. Аргуэльо Дж. Л. Вирусная геморрагическая болезнь кроликов: вакцинация и иммунный ответ. Rev Sci Tech Off Int Epiz. 1991; 10: 471–480. [PubMed] [Google Scholar]
Л. Вирусная геморрагическая болезнь кроликов: вакцинация и иммунный ответ. Rev Sci Tech Off Int Epiz. 1991; 10: 471–480. [PubMed] [Google Scholar]
3. Барсена Дж., Бласко Р. Рекомбинантный вирус оспы свиней, экспрессирующий β-галактозидазу: исследование диапазона вирусных хозяев и уровней экспрессии генов в клеточной культуре. Вирусология. 1998;243:396–405. [PubMed] [Google Scholar]
3a. Басена, Х., А. Пажес-Манте, Р. Марч, М. Моралес, М. А. Рамирес, Х. М. Санчес-Вискайно и Х. М. Торрес. Выделение аттенуированного полевого штамма вируса миксомы, который может обеспечить защиту от миксоматоза при контакте вакцинированных. Арка Вирол., в печати. [PubMed]
4. Bertagnoli S, Gelfi J, Gall G, Boilletot E, Vautherot J F, Rasschaert D, Laurent S, Petit F, Boucraut-Baralon C, Milon A. Защита от миксоматоза и вирусной геморрагической болезни кроликов с рекомбинантной миксомой вирусы, экспрессирующие капсидный белок вируса геморрагической болезни кроликов. Дж Вирол. 1996;70:5061–5066. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж Вирол. 1996;70:5061–5066. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Bertagnoli S, Gelfi J, Petit F, Vautherot J F, Rasschaert D, Laurent S, Gall G, Boilletot E, Chantal J, Boucraut-Baralon C. Защита кроликов против вирусной геморрагической болезни кроликов рекомбинантным вирусом коровьей оспы-RHDV. вакцина. 1996; 14: 506–510. [PubMed] [Google Scholar]
6. Бласко Р., Коул Н. Б., Мосс Б. Анализ последовательности, экспрессия и удаление гена вируса осповакцины, кодирующего гомолог профилина, эукариотического актин-связывающего белка. Дж Вирол. 1991;65:4598–4608. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Бласко Р., Мосс Б. Отбор рекомбинантных вирусов коровьей оспы на основе образования бляшек. Ген. 1995; 158: 157–162. [PubMed] [Google Scholar]
8. Бога Дж. А., Касаис Р., Марин М. С., Мартин-Алонсо Дж. М., Карменес Р. С., Прието М., Парра Ф. Молекулярное клонирование, секвенирование и экспрессия в Escherichia coli гена капсидного белка из вируса геморрагической болезни кроликов (изолят из Испании AST/89) J Gen Virol. 1994;75:2409–2413. [PubMed] [Google Scholar]
1994;75:2409–2413. [PubMed] [Google Scholar]
9. Boga J A, Martín-Alonso J M, Casais R, Parra F. Однократная иммунизация основным капсидным белком вируса геморрагической болезни кроликов, продуцируемым в Saccharomyces cerevisiae , вызывает защиту. Джей Ген Вирол. 1997;78:2315–2318. [PubMed] [Google Scholar]
10. Brochier B, Aubert MF, Pastoret PP, Masson E, Schon J, Lombard M, Chappuis G, Languet B, Desmettre P. Полевое использование рекомбинантной вакцины против коровьей оспы и бешенства для контроля лесного бешенства в Европе и Северной Америке. Rev Sci Tech Off Int Epizoot. 1996;15:947–970. [PubMed] [Google Scholar]
11. Буллер Р.М.Л., Смит Г.Л., Кремер К., Ноткинс А.Л., Мосс Б. Снижение вирулентности векторов экспрессии рекомбинантного вируса осповакцины связано с тимидинкиназ-отрицательным фенотипом. Природа (Лондон) 1985; 317: 813–815. [PubMed] [Google Scholar]
12. Castañón S, Marín M S, Martín-Alonso J M, Boga J A, Casais R, Humara J M, Ordás R J, Parra F. Иммунизация растениями картофеля, экспрессирующими белок VP60, защищает от вируса геморрагической болезни кроликов. . Дж Вирол. 1999;73:4452–4455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иммунизация растениями картофеля, экспрессирующими белок VP60, защищает от вируса геморрагической болезни кроликов. . Дж Вирол. 1999;73:4452–4455. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Чейси Д. Геморрагическая болезнь кроликов: новый бич Oryctolagus cuniculus . Лаборатория Аним. 1997; 31:33–44. [PubMed] [Google Scholar]
14. Cooke B D. Заметки по сравнительной репродуктивной биологии и лабораторному разведению кроличьей блохи Xenopsylla cunicularis Smit (Siphonaptera: Pulicidae) Aust J Zool. 1990; 38: 527–534. [Google Scholar]
15. де ла Пенья П., Заслофф М. Усиление ядерного транспорта мРНК с помощью промоторных элементов. Клетка. 1987;50:613–619. [PubMed] [Google Scholar]
16. Эрл П.Л., Мосс Б. Создание рекомбинантных вирусов коровьей оспы. В: Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Struhl K, редакторы. Текущие протоколы в молекулярной биологии. Нью-Йорк, штат Нью-Йорк: Greene Publishing Associates и Wiley Interscience; 1991. С. 16.17.1–16.17.16. [Google Scholar]
С. 16.17.1–16.17.16. [Google Scholar]
17. Фолкнер Ф.Г., Мосс Б. Переходный доминантный отбор рекомбинантных вирусов коровьей оспы. Дж Вирол. 1990;64:3108–3111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Феннер Ф., Рэтклифф Ф. Н. Миксоматоз. Кембридж, Англия: Издательство Кембриджского университета; 1965. [Google Scholar]
19. Fenner F, Ross J. Миксоматоз. В: Томпсон Х.В., Кинг С.М., редакторы. Европейский кролик. История и биология успешного колонизатора. Оксфорд, Англия: Издательство Оксфордского университета; 1994. С. 205–240. [Google Scholar]
20. Fischer L, Le Gros FX, Mason PW, Paoletti E. Рекомбинантный вирус оспы канареек защищает кроликов от вируса смертельной геморрагической болезни кроликов (RHDV). вакцина. 1997;15:90–96. [PubMed] [Google Scholar]
21. Ху Л., Эспозито Дж. Дж., Скотт Ф. В. Рекомбинантный вирус панлейкопении кошек VP2 поксвируса енота защищает кошек от заражения FPV. Вирусология. 1996; 218: 248–252. [PubMed] [Google Scholar]
22. Джексон Р. Дж., Бултс Х. Г. Ген тимидинкиназы вируса миксомы: последовательность и картирование транскрипции. Джей Ген Вирол. 1992; 73: 323–328. [PubMed] [Google Scholar]
Джексон Р. Дж., Бултс Х. Г. Ген тимидинкиназы вируса миксомы: последовательность и картирование транскрипции. Джей Ген Вирол. 1992; 73: 323–328. [PubMed] [Google Scholar]
23. Джексон Р. Дж., Бултс Х. Г. Межгенный транзиторно-доминантный вектор селекции вируса миксомы. Джей Ген Вирол. 1992;73:3241–3245. [PubMed] [Google Scholar]
24. Джексон Р. Дж., Холл Д. Ф., Керр П. Дж. Конструирование рекомбинантных вирусов миксомы, экспрессирующих чужеродные гены из разных межгенных сайтов без связанной аттенуации. Джей Ген Вирол. 1996; 77: 1569–1575. [PubMed] [Google Scholar]
25. Хименес Г., Корреа И., Мельгоса М.П., Буллидо М.Дж., Энхуанес Л. Критические эпитопы в нейтрализации вируса трансмиссивного гастроэнтерита. Дж Вирол. 1986; 64: 6270–6273. [Google Scholar]
26. Керр П. Дж., Бест С. М. Вирус миксомы кроликов. Rev Sci Tech Off Int Epizoot. 1998;17:256–268. [PubMed] [Google Scholar]
27. Керр П. Дж., Джексон Р. Дж. Вирус миксомы как вакцинный вектор для кроликов: уровни антител к гемагглютинину вируса гриппа, представленные рекомбинантным вирусом миксомы. вакцина. 1995; 13: 1722–1726. [PubMed] [Google Scholar]
вакцина. 1995; 13: 1722–1726. [PubMed] [Google Scholar]
28. Laurent S, Vautherot J F, Madelaine MF, Le Gall G, Rasschaert D. Рекомбинантный капсидный белок вируса геморрагической болезни кроликов, экспрессируемый в бакуловирусе, самособирается в вирусоподобные частицы и вызывает защиту. Дж Вирол. 1994;68:6794–6798. [Статья бесплатно PMC] [PubMed] [Google Scholar]
29. Le Gall G, Arnauld C, Boilletot E, Morisse JP, Rasschaert D. Молекулярная эпидемиология вспышек вируса геморрагической болезни кроликов во Франции в 1988–1995 гг. Джей Ген Вирол. 1998; 79: 11–16. [PubMed] [Google Scholar]
30. Liu S J, Xue H P, Pu B Q, Qian SH. Новое вирусное заболевание кроликов. Anim Husb Vet Med. 1984; 16: 253–255. [Google Scholar]
31. Marchandeau S, Chantal J, Portejoie Y, Barraud S, Chaval Y. Воздействие вирусной геморрагической болезни на дикую популяцию европейских кроликов во Франции. Дж. Уайлдл Дис. 1998;34:429–435. [PubMed] [Google Scholar]
32. Марин М. С., Мартин-Алонсо Дж. М., Перес-Ордойо Л. И., Бога Дж. А., Аргуэльо-Вильярес Дж. Л., Касаис Р., Венугопал К., Цзян В., Гулд Э. А., Парра Ф. Иммуногенные свойства Структурный белок вируса геморрагической болезни кроликов VP60, экспрессируемый рекомбинантным бакуловирусом: эффективная вакцина. Вирус рез. 1995; 39: 119–128. [PubMed] [Google Scholar]
С., Мартин-Алонсо Дж. М., Перес-Ордойо Л. И., Бога Дж. А., Аргуэльо-Вильярес Дж. Л., Касаис Р., Венугопал К., Цзян В., Гулд Э. А., Парра Ф. Иммуногенные свойства Структурный белок вируса геморрагической болезни кроликов VP60, экспрессируемый рекомбинантным бакуловирусом: эффективная вакцина. Вирус рез. 1995; 39: 119–128. [PubMed] [Google Scholar]
33. Мартин-Алонсо Дж. М., Балбин М., Гарвес Д. Дж., Энхуанес Л., Гаскон С., Парра Ф. Антигенная структура нуклеопротеина вируса трансмиссивного гастроэнтерита. Вирусология. 1992;188:168–174. [Статья бесплатно PMC] [PubMed] [Google Scholar]
34. Matsuura Y, Posee RD, Overton HA, Bishop DHL. Бакуловирусные экспрессионные векторы: требования для высокого уровня экспрессии белков, включая гликопротеины. Джей Ген Вирол. 1987; 68: 1233–1250. [PubMed] [Google Scholar]
35. Меллор Дж., Добсон М.Дж., Робертс Н.А., Туите М.Ф., Эмтадж Дж.С., Уайт С., Лоу П.А., Патель Т., Кингсман А.Дж., Кингсман С.М. Эффективный синтез ферментативно активного химозина телят в Saccharomyces cerevisiae .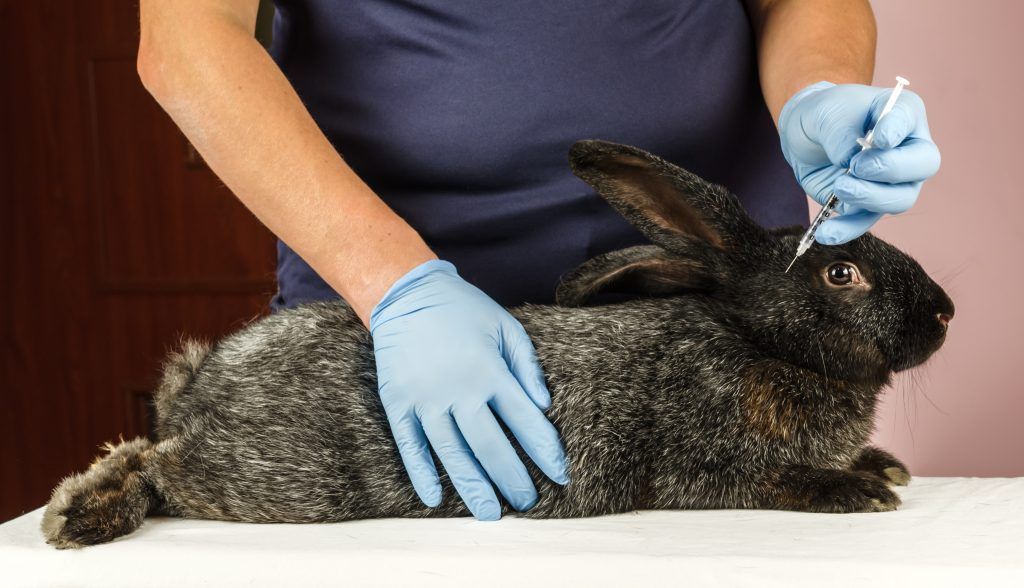 Ген. 1983; 24:1–14. [PubMed] [Google Scholar]
Ген. 1983; 24:1–14. [PubMed] [Google Scholar]
36. Messud-Petit F, Gelfi J, Delverdier M, Amardeilh MF, Py R, Sutter G, Bertagnoli S. Serp2, ингибитор интерлейкин-1β-превращающего фермента, играет важную роль в Патобиология вируса миксомы. Дж Вирол. 1998;72:7830–7839. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Morise JP, Le Gall G, Boilleot E. Гепатит вирусного происхождения у leporidae: введение и этиологические гипотезы. Rev Sci Tech Off Int Epizoot. 1991;10:283–295. [PubMed] [Google Scholar]
38. Мосс Б. Генетически модифицированные поксвирусы для экспрессии рекомбинантных генов, вакцинации и безопасности. Proc Natl Acad Sci USA. 1996; 93:11341–11348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Мерфи Ф.А., Фоке С.М., Бишоп Д.Х.Л., Габриал С.А., Джарвис А.В., Мартелли Г.П., Майо М.А., Саммерс М.Д., редакторы. Таксономия вирусов: классификация и номенклатура вирусов. Шестой доклад Международного комитета по таксономии вирусов. Архив вирусологии, Доп. 10. Вена, Австрия: Springer Verlag; 1995. [Google Scholar]
10. Вена, Австрия: Springer Verlag; 1995. [Google Scholar]
40. Mutze G, Cooke B, Alexander P. Первоначальное влияние геморрагической болезни кроликов на популяции европейских кроликов в Южной Австралии. Дж. Уайлдл Дис. 1998; 34: 221–227. [PubMed] [Google Scholar]
41. Nagesha H S, Wang L F, Hyatt A D, Morrissy C J, Lenghaus C, Westbury H A. Самосборка, антигенность и иммуногенность вируса геморрагической болезни кроликов (чехословацкий штамм V-351). ) капсидный белок экспрессируется в бакуловирусе. Арх Вирол. 1995;140:1095–1108. [PubMed] [Google Scholar]
42. Новотны Н., Рос-Баскунана С., Баллаги-Пордани А., Гавьер-Виден Д., Улен М., Белак С. Филогенетический анализ вирусов геморрагической болезни кроликов и синдрома европейского зайца путем сравнения последовательности гена капсидного белка. Арх Вирол. 1997; 142: 657–673. [PubMed] [Google Scholar]
43. Ohlinger V F, Haas B, Meyers G, Weiland F, Thiel H J. Идентификация и характеристика вируса, вызывающего геморрагическую болезнь кроликов. Дж Вирол. 1990;64:3331–3336. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж Вирол. 1990;64:3331–3336. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Ohlinger V F, Thiel H J. Геморрагическая болезнь кроликов (RHD): характеристика возбудителя калицивируса. Вет рез. 1993; 24:103–116. [PubMed] [Google Scholar]
45. Opgenorth A, Graham KA, Nation N, Strayer D, McFadden G. Делеционный анализ двух тандемно расположенных генов вирулентности в вирусе миксомы: M11L и фактора роста миксомы. Дж Вирол. 1992;66:4720–4731. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Пагес А., Коста Л. Контроль срединной вакцины против геморрагической геморрагии (RHDV). Мед Вет. 1990;7:93–96. [Google Scholar]
47. Pagès A, Espuña E. Estudios sobre la aplication de vacunas homólogas de mixomatosis en conejos silvestres. Мед Вет. 1988; 5: 365–374. [Google Scholar]
48. Parra F, Prieto M. Очистка и характеристика калицивируса как возбудителя смертельной геморрагической болезни кроликов. Дж Вирол. 1990;64:4013–4015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Petit F, Boucraut-Baralon C, Py R, Bertagnoli S. Анализ генома вируса миксомы с использованием гель-электрофореза в пульсирующем поле. Вет микробиол. 1996;50:27–32. [PubMed] [Google Scholar]
Petit F, Boucraut-Baralon C, Py R, Bertagnoli S. Анализ генома вируса миксомы с использованием гель-электрофореза в пульсирующем поле. Вет микробиол. 1996;50:27–32. [PubMed] [Google Scholar]
50. Plana-Duran J, Bastons M, Rodriguez M J, Climent I, Cortés E, Vela C, Casal I. Пероральная иммунизация кроликов частицами VP60 обеспечивает защиту от геморрагической болезни кроликов. Арх Вирол. 1996; 141:1423–1436. [PubMed] [Google Scholar]
51. Pringle CR. Таксономия вирусов — Сан-Диего, 1998. Arch Virol. 1998; 143:1449–1459. [PubMed] [Google Scholar]
52. Робинсон А. Дж., Джексон Р., Керр П., Мерчант Дж., Парер И., Печ Р. Прогресс в использовании рекомбинантного вируса миксомы в качестве вектора для контроля фертильности у кроликов. Репродукция Fertil Dev. 1997;9:77–83. [PubMed] [Google Scholar]
53. Ромеро Ч., Барретт Т., Чемберлен Р. В., Китчинг Р. П., Флеминг М., Блэк Д. Н. Рекомбинантный каприпоксвирус, экспрессирующий ген белка гемагглютинина вируса чумы крупного рогатого скота: защита крупного рогатого скота от чумы крупного рогатого скота и нодулярного дерматита. вирусы. Вирусология. 1994; 204:425–429. [PubMed] [Google Scholar]
вирусы. Вирусология. 1994; 204:425–429. [PubMed] [Google Scholar]
54. Saito J K, McKercher DG, Castrucci G. Аттенуация вируса миксомы и использование живого аттенуированного вируса в качестве иммунизирующего агента против миксоматоза. J заразить Dis. 1964;114:417–427. [PubMed] [Google Scholar]
55. Saurat P, Gilbert Y, Ganière J P. Etude d’une souche de virus myxomateux modifie. Преподобный мед. вет. 1978; 129: 415–451. [Google Scholar]
56. Sibilia M, Boniotti MB, Angoscini P, Capucci L, Rossi C. Два независимых пути экспрессии приводят к самосборке капсидного белка вируса геморрагической болезни кроликов. Дж Вирол. 1995; 69: 5812–5815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Trout RC, Ross J, Tittensor AM, Fox AP. Влияние на популяцию британских диких кроликов ( Oryctolagus cuniculus ) лечения миксоматоза. J Appl Ecol. 1993; 29: 679–686. [Google Scholar]
58. Van der Leek M L, Feller J A, Sorensen G, Isaacson W, Adams C L, Borde D J, Pfeiffer N, Tran T, Moyer R W, Gibbs E P J. Оценка вируса оспы свиней в качестве вакцинного вектора в свиней с использованием генной вставки вируса болезни Ауески (псевдобешенства), кодирующей гликопротеины gp50 и gp63. Ветеринар Рек. 1994; 134:13–18. [PubMed] [Google Scholar]
Оценка вируса оспы свиней в качестве вакцинного вектора в свиней с использованием генной вставки вируса болезни Ауески (псевдобешенства), кодирующей гликопротеины gp50 и gp63. Ветеринар Рек. 1994; 134:13–18. [PubMed] [Google Scholar]
59. Villafuerte R, Calvete C, Blanco JC, Lucientes J. Заболеваемость вирусной геморрагической болезнью в популяциях диких кроликов в Испании. млекопитающих. 1995;59:651–659. [Google Scholar]
60. Villafuerte R, Calvete C, Górtazar Z, Moreno S. Первая эпизоотия геморрагической болезни кроликов в свободноживущих популяциях Oryctolagus cuniculus в национальном парке Доньяна, юго-запад Испании. Дж. Уайлдл Дис. 1994; 30: 176–179. [PubMed] [Google Scholar]
61. Уильямс К., Парер И., Коман Б., Берли Дж., Брайшер М. Борьба с позвоночными вредителями: кролики. Бюро наук о ресурсах / CSIRO Отдел дикой природы и экологии. Канберра, Австралия: Издательская служба правительства Австралии; 1995. [Google Scholar]
62. Wirblich C, Thiel HJ, Meyers G. Генетическая карта калицивирусного вируса геморрагической болезни кроликов, полученная из in vitro переводческих исследований. Дж Вирол. 1996; 70: 7974–7983. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Генетическая карта калицивирусного вируса геморрагической болезни кроликов, полученная из in vitro переводческих исследований. Дж Вирол. 1996; 70: 7974–7983. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Rabbit Welfare Association & Fund (RWAF)
Миксоматоз — тяжелое вирусное заболевание кроликов, уничтожившее популяцию диких кроликов, когда они прибыли в Великобританию 70 лет назад.
Домашние кролики также восприимчивы к этой болезни, и каждый год регистрируется гибель домашних животных.
Как домашние животные могут заразиться миксоматозом?
Основной путь заражения – блохи и комары, которые предварительно укусили инфицированного кролика. Также есть подозрение, что болезнь могут передавать мошки и клещи. Прямой контакт с инфицированными кроликами также может распространять болезнь, особенно выделения от их дыхания и прямого контакта.
Все домашние кролики — в помещении или на улице — подвержены риску. Кролики, живущие на улице (особенно если дикие кролики проникают в сад), подвергаются особо высокому риску.
Как я могу защитить своих кроликов от миксоматоза?
Вакцинация является самой важной мерой, которую вы должны предпринять, чтобы защитить своих кроликов.
Кроликов следует вакцинировать против Myxi как можно раньше. Проконсультируйтесь со своим ветеринаром, разбирающимся в кроликах, относительно самого раннего возраста, в котором ваши кролики могут быть вакцинированы вместе со всеми последними протоколами. Бустеры нужны каждый год.
Миксоматоз Вакцинация не может гарантировать абсолютную защиту: вакцинированные кролики иногда заражаются миксоматозом. Однако у вакцинированных кроликов заболевание обычно протекает легче, иногда бывает единичное поражение кожи или непродолжительное, довольно незначительное заболевание. Этих инфицированных кроликов должен лечить дружелюбный к кроликам ветеринар, который сообщит об инфекции производителям вакцин.
Вакцинированные кролики с миксоматозом обычно выживают, тогда как невакцинированные кролики почти всегда погибают.
А также регулярная вакцинация:
- Если вы покупаете сено и солому напрямую у производителя, старайтесь использовать фермы, где фермер не видел ни одного кролика с миксоматозом на земле.
- Кормите сеном, извлеченным из пыли, или высушенной в печи травой
- Установите москитные сетки на вольеры
- Удалите стоячую воду (где могут размножаться комары) из вашего сада. Если у вас есть бочка для воды, добавьте в воду небольшое количество растительного масла. Это создаст на поверхности пленку, которая задушит личинок комаров. Еще лучше иметь герметичную крышку, чтобы дикие животные случайно не попали в
- Обработайте кошек и собак от блох, иначе они могут принести домой кроличьих блох. Поговорите со своим ветеринаром о борьбе с блохами: некоторые продукты токсичны для кроликов, а некоторые продукты для кроликов токсичны для кошек.
- Постарайтесь не дать диким кроликам проникнуть в ваш сад. Если это невозможно, сделайте так, чтобы дикие посетители не могли контактировать нос к носу с вашими домашними животными.


