Содержание
Вакцина «ИНФАНРИКС ГЕКСА» | Детский медицинский центр «ЧудоДети»
«ИНФАНРИКС ГЕКСА» — прививка от дифтерии, столбняка, коклюша, полиомиелита, гепатита В, и Haemophilus influenzae типа b (Hib)
Вакцина комбинированная, шестивалентная
Производитель: ГлаксоСмитКляйн Байолоджикалз, Бельгия.
Защищает от заболеваний: дифтерия, столбняк, коклюш, полиомиелит, гепатит B и Haemophilus influenzae типа b.
Применяется: у детей в первый и второй год жизни.
Включена в национальный календарь прививок.
Преимущества вакцины «Инфанрикс Гекса»
- Минимальное количество побочных эффектов по сравнению с АКДС.
- Защитный эффект в отношении трех типов полиовирусов наблюдается у 91% вакцинированных детей в возрасте 4-8 лет, против дифтерии и столбняка у 64,7% детей, против коклюша у 87% детей.
- Иммунитет против Hib инициируется у 96% привитых детей.
- Защитный эффект против гепатита В сохраняется у 48% в возрасте 11-12 лет.

- Имеющиеся клинические данные более чем из 10-летнего опыта работы с вакциной свидетельствуют о том, что «Инфанрикс Гекса» в качестве первичной и повторной вакцинации является безопасным и полезным вариантом для обеспечения защиты от распространенных детских болезней, дифтерии и столбняка.
- Вакцина косвенно защищает от гепатита D, который не возникает в отсутствии гепатита В.
Показания для вакцинации «Инфанрикс Гекса»
Вакцина показана для профилактики дифтерии, столбняка, коклюша (коклюша), полиомиелита, гепатита B и Haemophilus influenzae типа b (Hib) у детей первого и второго года жизни.
Совместимость с другими вакцинами
Вакцину Инфанрикс Гекса можно вводить вместе с любыми другими вакцинами, кроме БЦЖ. Если до этого была сделана другая вакцина, то курс можно продолжить прививкой Инфанрикс Гекса.
Предостережения: применение у беременных и кормящих женщин
Вакцина не предназначена для вакцинации взрослых.
Противопоказания
Только врач может решить, подходит ли «Инфанрикс Гекса» для вакцинации
Вакцинация «Инфанрикс Гекса» противопоказана при наличии в анамнезе аллергической реакции на любой компонент вакцины, а также в следующих случаях:
- Гиперчувствительность к активным веществам или к любым вспомогательным веществам.

- Повышенная чувствительность после предыдущей вакцинации от дифтерии, столбняка, коклюша.
- Случай энцефалопатии в течение 7 дней после любой вакцинации против коклюша.
Возможные побочные эффекты
Наиболее часто наблюдаются следующие побочные эффекты:
- снижение или полная потеря аппетита
- место укола может покраснеть и болеть, может появиться отек
- ребенок может стать беспокойным и раздражительным, подолгу плакать
- повышение температуры тела до 39,5 градусов
Более редкие проявления реакции на вакцину:
- рвота и понос
- появление в месте вакцины уплотнения и покраснения
- аллергическая реакция
Приходите на прививки в «ЧудоДети». Полный спектр вакцин для детей и взрослых, семейная вакцинация — по специальной цене!
Новые возможности вакцинопрофилактики менингококковой инфекции у детей | Заплатников, Гирина А.А., Коровина Н.А., Свинцицкая В.И.
МИ — острая антропонозная инфекционная болезнь, вызываемая менингококком (Neisseria meningitidis), который по антигенной структуре подразделяется на 12 серогрупп (А, В, С, X, Y, Z, W-135, 29E, К, Н, L, I).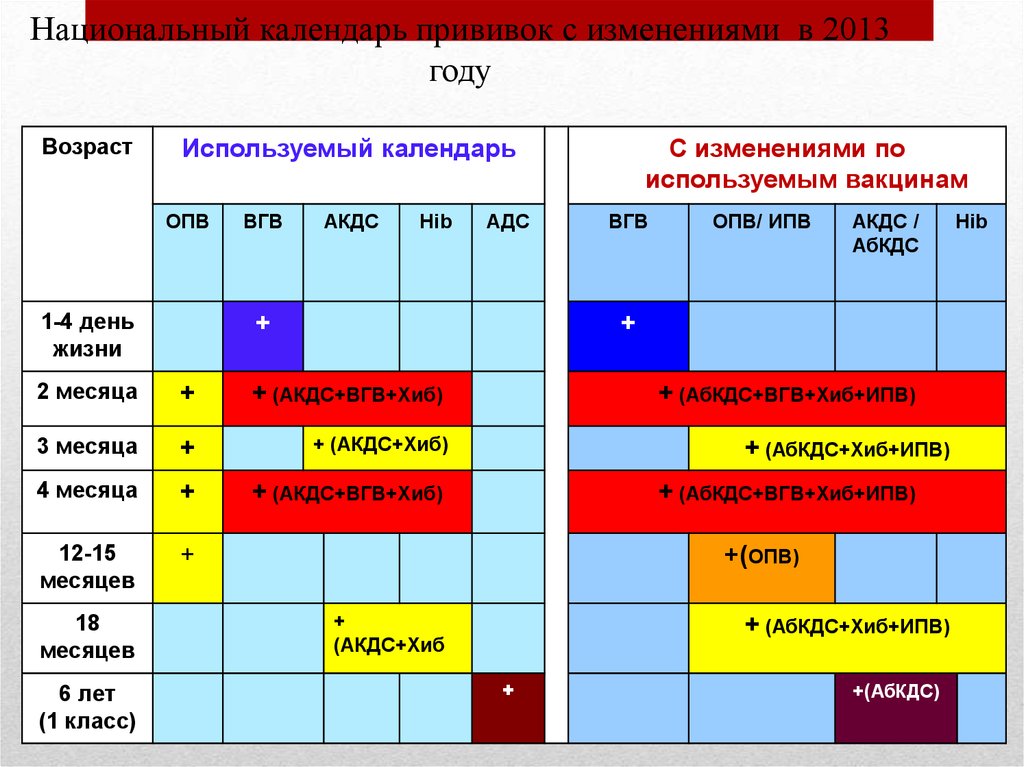 МИ характеризуется периодическими подъемами заболеваемости, которые возникают через длительные межэпидемические периоды (10–30 и более лет) и вызываются одной из серогрупп менингококка. Установлено, что эпидемические подъемы МИ до настоящего времени вызывали менингококки, А, В и С. При этом крупные эпидемии в ХХ в., охватывавшие многие страны мира, вызывались менингококком, А, в то время как подъемы заболеваемости в границах одной страны — менингококками В и С. В межэпидемическом периоде спорадическая заболеваемость связана с менингококками разных серогрупп, среди которых наиболее частыми возбудителями являются менингококки, А, В, C, Y, W-135 [1, 7–10, 12, 13, 21, 23].
МИ характеризуется периодическими подъемами заболеваемости, которые возникают через длительные межэпидемические периоды (10–30 и более лет) и вызываются одной из серогрупп менингококка. Установлено, что эпидемические подъемы МИ до настоящего времени вызывали менингококки, А, В и С. При этом крупные эпидемии в ХХ в., охватывавшие многие страны мира, вызывались менингококком, А, в то время как подъемы заболеваемости в границах одной страны — менингококками В и С. В межэпидемическом периоде спорадическая заболеваемость связана с менингококками разных серогрупп, среди которых наиболее частыми возбудителями являются менингококки, А, В, C, Y, W-135 [1, 7–10, 12, 13, 21, 23].
Источником МИ является человек, инфицированный менингококком. Путь передачи инфекции — воздушно-капельный. Показана также возможность заражения при поцелуях и через общие столовые приборы, посуду, если они контаминированы слюной инфицированнного человека. Источником инфекции являются больные (как инвазивными формами, так и локализованными) и бактерионосители (так называемые «здоровые носители»). Считается, что 10–20% населения являются носителями N. meningitidis. Несмотря на то, что для МИ свойственна зимне-весенняя сезонность, рост заболеваемости может отмечаться вне зависимости от сезона. Это характерно для вновь организуемых детских коллективов (дошкольные и учебные учреждения), а также при формировании новых коллективов подростков и молодых людей (колледжи и университеты, новобранцы в военных частях). Особо следует отметить, что наиболее высокий уровень заболеваемости МИ как в период эпидемии, так и в межэпидемический период регистрируется среди детей, особенно раннего возраста, и подростков [7–10, 12, 13, 17, 23].
Считается, что 10–20% населения являются носителями N. meningitidis. Несмотря на то, что для МИ свойственна зимне-весенняя сезонность, рост заболеваемости может отмечаться вне зависимости от сезона. Это характерно для вновь организуемых детских коллективов (дошкольные и учебные учреждения), а также при формировании новых коллективов подростков и молодых людей (колледжи и университеты, новобранцы в военных частях). Особо следует отметить, что наиболее высокий уровень заболеваемости МИ как в период эпидемии, так и в межэпидемический период регистрируется среди детей, особенно раннего возраста, и подростков [7–10, 12, 13, 17, 23].
На современном этапе эпидситуация по МИ в Российской Федерации характеризуется тем, что за последние 20 лет существенно снизилась как заболеваемость генерализованными формами МИ (в 2,7 раза), так и число летальных исходов (в 2,1 раза) [1, 5, 8]. В то же время настораживает тот факт, что, как и раньше, подавляющее большинство среди заболевших и умерших от МИ составляют дети, преимущественно первых 5 лет жизни. Так, в 2013 г. среди всех случаев генерализованной МИ более 83% приходилось на детский возраст. При этом если заболеваемость генерализованными формами МИ по совокупному населению составляла 0,79 на 100 тыс., среди детей от 0 до 17 лет включительно — 2,99, то в возрастной когорте 0–5 лет — 7,4. Наиболее высокий уровень заболеваемости при этом был отмечен у детей первого года жизни — 13,9 на 100 тыс. детского населения. Обращено также внимание на существенное преобладание детей в возрастной структуре умерших при генерализованных формах МИ. Так, в 2013 г. среди всех случаев летальных исходов от генерализованных форм МИ до 76% приходилось на детский возраст. Отмечено также, что, несмотря на современные терапевтические возможности, средний уровень летальности при генерализованных формах МИ у детей составляет 16,4% [5, 8].
Так, в 2013 г. среди всех случаев генерализованной МИ более 83% приходилось на детский возраст. При этом если заболеваемость генерализованными формами МИ по совокупному населению составляла 0,79 на 100 тыс., среди детей от 0 до 17 лет включительно — 2,99, то в возрастной когорте 0–5 лет — 7,4. Наиболее высокий уровень заболеваемости при этом был отмечен у детей первого года жизни — 13,9 на 100 тыс. детского населения. Обращено также внимание на существенное преобладание детей в возрастной структуре умерших при генерализованных формах МИ. Так, в 2013 г. среди всех случаев летальных исходов от генерализованных форм МИ до 76% приходилось на детский возраст. Отмечено также, что, несмотря на современные терапевтические возможности, средний уровень летальности при генерализованных формах МИ у детей составляет 16,4% [5, 8].
Высокий уровень заболеваемости генерализованными формами МИ у детей и серьезность прогноза при этом (высокая летальность и инвалидизация выживших) определили необходимость поиска наиболее действенных мер предупреждения МИ. При этом позиция ВОЗ по вопросам профилактики МИ заключается в следующем: химиопрофилактика может предотвратить вторичные случаи заболевания среди контактных лиц, но, поскольку вторичные случаи составляют только 1–2% от всех случаев МИ, химиопрофилактика не имеет большого значения в борьбе с заболеванием, вызывающим эпидемии. Поскольку от 5 до 15% детей и молодых людей являются носителями менингококков в носоглотке, борьба с МИ, основанная на химиотерапевтической элиминации носительства в носоглотке, практически невозможна, за исключением небольших и закрытых организованных коллективов. Поэтому иммунизация с использованием безопасных и эффективных вакцин является единственным рациональным подходом к борьбе с МИ [23, 27].
При этом позиция ВОЗ по вопросам профилактики МИ заключается в следующем: химиопрофилактика может предотвратить вторичные случаи заболевания среди контактных лиц, но, поскольку вторичные случаи составляют только 1–2% от всех случаев МИ, химиопрофилактика не имеет большого значения в борьбе с заболеванием, вызывающим эпидемии. Поскольку от 5 до 15% детей и молодых людей являются носителями менингококков в носоглотке, борьба с МИ, основанная на химиотерапевтической элиминации носительства в носоглотке, практически невозможна, за исключением небольших и закрытых организованных коллективов. Поэтому иммунизация с использованием безопасных и эффективных вакцин является единственным рациональным подходом к борьбе с МИ [23, 27].
Первая менингококковая вакцина (полисахаридная вакцина против менингокока серотипов, А и С) была создана в 1969 г. и показала свою эффективность в борьбе с эпидемией МИ в Бразилии в 1970-е гг. В дальнейшем разными производителями были созданы различные полисахаридные моно- и комбинированные менингококковые вакцины. Они успешно применялись для снижения риска МИ у детей, подростков и взрослых, а также у пациентов групп риска, однако все они оказались малоэффективными для предупреждения МИ у самой уязвимой возрастной группы — младенцев и детей первых 2-х лет жизни [2, 16, 20, 27]. Для того чтобы объяснить выявленный феномен, необходимо вспомнить, что все эти вакцины являются полисахаридными, т. е. содержат полисахариды бактериальной капсулы, которые относятся к Т-независимым антигенам [25, 26].
Они успешно применялись для снижения риска МИ у детей, подростков и взрослых, а также у пациентов групп риска, однако все они оказались малоэффективными для предупреждения МИ у самой уязвимой возрастной группы — младенцев и детей первых 2-х лет жизни [2, 16, 20, 27]. Для того чтобы объяснить выявленный феномен, необходимо вспомнить, что все эти вакцины являются полисахаридными, т. е. содержат полисахариды бактериальной капсулы, которые относятся к Т-независимым антигенам [25, 26].
Антигены (АГ) в зависимости от особенностей иммунных реакций, которые они индуцируют, делят на 2 основные группы: Т-зависимые и Т-независимые. При этом те АГ, иммунный ответ на которые формируется благодаря кооперации Т- и В-лимфоцитов, называют Т-зависимыми. Если АГ распознаются непосредственно В-лимфоцитами без участия Т-клеток, то их относят к Т-независимым [2, 4, 25, 26].
Активация макрофагов и дендритных клеток Т-зависимыми АГ приводит к усилению экспрессии на них АГ главного комплекса гистосовместимости II класса (МНС II). При этом Т-зависимые АГ в комбинации с молекулами МНС II распознаются Т-лимфоцитами-хелперами (Т-хелперы) за счет взаимодействия с Т-клеточным рецептором. Потенцирование Т-клеточного рецептора АГ и МНС II приводит к активации Т-хелперов (рис. 1). В результате этого в активированных Т-хелперах индуцируются продукция и синтез таких цитокинов, как интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) и интерлейкин-5 (ИЛ-5). ИЛ-2 является фактором роста для многих иммунных клеток, а ИЛ-4 и ИЛ-5 повышают активность В-лимфоцитов. Кроме этого, в активированных Т-хелперах синтезируется СD-40L — лиганд для рецептора СD-40, экспрессируемого на антигенпредставляющих клетках. Молекула СD-40L является ко-стимуляторомТ-клеточного рецептора в индукции активности В-лимфоцитов. Взаимодействие СD-40L с рецептором СD-40 сопровождается регуляцией функциональной активности В-лимфоцитов. В результате комплексного воздействия на примированный В-лимфоцитИЛ-4, ИЛ-5, СD-40L происходит его трансформация в плазмоцит, стимулируется образование антител, закладываются В-клетки памяти (рис.
При этом Т-зависимые АГ в комбинации с молекулами МНС II распознаются Т-лимфоцитами-хелперами (Т-хелперы) за счет взаимодействия с Т-клеточным рецептором. Потенцирование Т-клеточного рецептора АГ и МНС II приводит к активации Т-хелперов (рис. 1). В результате этого в активированных Т-хелперах индуцируются продукция и синтез таких цитокинов, как интерлейкин-2 (ИЛ-2), интерлейкин-4 (ИЛ-4) и интерлейкин-5 (ИЛ-5). ИЛ-2 является фактором роста для многих иммунных клеток, а ИЛ-4 и ИЛ-5 повышают активность В-лимфоцитов. Кроме этого, в активированных Т-хелперах синтезируется СD-40L — лиганд для рецептора СD-40, экспрессируемого на антигенпредставляющих клетках. Молекула СD-40L является ко-стимуляторомТ-клеточного рецептора в индукции активности В-лимфоцитов. Взаимодействие СD-40L с рецептором СD-40 сопровождается регуляцией функциональной активности В-лимфоцитов. В результате комплексного воздействия на примированный В-лимфоцитИЛ-4, ИЛ-5, СD-40L происходит его трансформация в плазмоцит, стимулируется образование антител, закладываются В-клетки памяти (рис. 1). Кроме этого, стимулируются процессы переключения изотипа синтеза антител (с IgМ на IgG) и нарастания их аффинности в динамике. Благодаря этому после первичного иммунного ответа концентрация антител (класса IgG) в течение длительного времени может сохраняться на протективном уровне (рис. 2). При повторном контакте с Т-зависимыми АГ в дальнейшем в организме за счет ранее сформировавшейся иммунологической памяти сразу же начинается продукция специфических антител класса IgG, их концентрация значимо нарастает (рис. 2), что позволяет очень быстро элиминировать возбудитель (вторичный иммунный ответ). Именно этот механизм и препятствует развитию инфекционного заболевания при повторном контакте с Т-зависимыми АГ, если ранее был сформирован полноценный иммунный ответ [2, 4, 16, 17, 25, 26].
1). Кроме этого, стимулируются процессы переключения изотипа синтеза антител (с IgМ на IgG) и нарастания их аффинности в динамике. Благодаря этому после первичного иммунного ответа концентрация антител (класса IgG) в течение длительного времени может сохраняться на протективном уровне (рис. 2). При повторном контакте с Т-зависимыми АГ в дальнейшем в организме за счет ранее сформировавшейся иммунологической памяти сразу же начинается продукция специфических антител класса IgG, их концентрация значимо нарастает (рис. 2), что позволяет очень быстро элиминировать возбудитель (вторичный иммунный ответ). Именно этот механизм и препятствует развитию инфекционного заболевания при повторном контакте с Т-зависимыми АГ, если ранее был сформирован полноценный иммунный ответ [2, 4, 16, 17, 25, 26].
Т-независимые АГ распознаются непосредственно В-лимфоцитами, без участия Т-клеток, что связывают с особенностями их молекулярной структуры [4, 25]. При этом Т-независимые АГ являются чрезвычайно сильными индукторами синтеза в макрофагах таких цитокинов, как ИЛ-1, ИЛ-6 и фактор некроза опухоли α (ФНО-α). Все перечисленные интерлейкины являются провоспалительными цитокинами. Так, ИЛ-1 активирует лимфоциты, стимулирует макрофаги, усиливает адгезию лейкоцитов и эндотелиальных клеток, а также потенцирует продукцию белков острой фазы воспаления. Аналогичными эффектами, а также возможностью активации гранулоцитов и цитотоксических клеток обладает ФНО-α. ИЛ-6 также стимулирует продукцию белков острой фазы воспаления и усиливает дифференцировку В-лимфоцитов. Особо следует отметить, что при стимуляции макрофагов Т-независимыми АГ не запускается механизм активации Т-лимфоцитов, из-за чего не происходит синтез ИЛ-4, ИЛ-5 и не образуются лиганды СD-40L для молекул СD-40, расположенных на поверхности В-клеток [4, 25]. В-лимфоциты, примированные АГ и стимулированные ИЛ-1 и ИЛ-6, трансформируются в плазмоциты без участия Т-клеток и начинают синтезировать антитела. Однако из-за особенностей цитокинового окружения (нет активирующего влияния ИЛ-4, ИЛ-5) и отсутствия соответствующей ко-стимуляции молекулами СD-40L формирования клеток иммунологической памяти не происходит (рис.
Все перечисленные интерлейкины являются провоспалительными цитокинами. Так, ИЛ-1 активирует лимфоциты, стимулирует макрофаги, усиливает адгезию лейкоцитов и эндотелиальных клеток, а также потенцирует продукцию белков острой фазы воспаления. Аналогичными эффектами, а также возможностью активации гранулоцитов и цитотоксических клеток обладает ФНО-α. ИЛ-6 также стимулирует продукцию белков острой фазы воспаления и усиливает дифференцировку В-лимфоцитов. Особо следует отметить, что при стимуляции макрофагов Т-независимыми АГ не запускается механизм активации Т-лимфоцитов, из-за чего не происходит синтез ИЛ-4, ИЛ-5 и не образуются лиганды СD-40L для молекул СD-40, расположенных на поверхности В-клеток [4, 25]. В-лимфоциты, примированные АГ и стимулированные ИЛ-1 и ИЛ-6, трансформируются в плазмоциты без участия Т-клеток и начинают синтезировать антитела. Однако из-за особенностей цитокинового окружения (нет активирующего влияния ИЛ-4, ИЛ-5) и отсутствия соответствующей ко-стимуляции молекулами СD-40L формирования клеток иммунологической памяти не происходит (рис. 3). Кроме того, имеются данные, что при этом нет адекватного переключения изотипа антител — продолжается синтез IgM без последующей замены их на IgG. Показано также, что аффинность антител в динамике не нарастает. В связи с этим уже через небольшой период времени после распознавания Т-независимого АГ интенсивность иммунного ответа значительно снижается, а затем и полностью исчезает. В дальнейшем, при повторных контактах с этим АГ, иммунные реакции вновь протекают по типу первичного ответа (рис. 4), без формирования стойкого иммунитета и закладки клеток памяти [4, 25].
3). Кроме того, имеются данные, что при этом нет адекватного переключения изотипа антител — продолжается синтез IgM без последующей замены их на IgG. Показано также, что аффинность антител в динамике не нарастает. В связи с этим уже через небольшой период времени после распознавания Т-независимого АГ интенсивность иммунного ответа значительно снижается, а затем и полностью исчезает. В дальнейшем, при повторных контактах с этим АГ, иммунные реакции вновь протекают по типу первичного ответа (рис. 4), без формирования стойкого иммунитета и закладки клеток памяти [4, 25].
Т-независимые АГ представлены главным образом крупными полимерными молекулами с повторяющимися антигенными детерминантами, устойчивыми к деградации. Предполагают, что полимерная структура этих АГ позволяет им перекрестно реагировать с В-клеточными рецепторами, надолго связывая их за счет своей устойчивости к деградации. Полисахариды бактериальной капсулы полностью соответствуют указанным выше особенностям, что и определяет формирование иммунного ответа на них без участия Т-лимфоцитов. В связи с этим на все инкапсулированные бактерии, к которым относятся и менингококки, не формируется долгосрочный и стойкий иммунитет. Высказывается предположение, что у детей раннего возраста это усугубляется еще и незрелостью В-лимфоцитов, что приводит к крайне низкой активности иммунного ответа и обусловливает высокую восприимчивость данного контингента к инкапсулированным возбудителям (менингококк, пневмококк, Hib и др.), частое развитие при этом инвазивных форм заболевания со значительным уровнем неблагоприятных исходов. С учетом того, что распознавание Т-независимых АГ происходит в краевой зоне селезенки (над мантией), где сконцентрированы специализированные макрофаги и В-лимфоциты, отвечающие на Т-независимые АГ, становится понятным, почему пациенты с аспленией (анатомической и функциональной) относятся к группе высокого риска по развитию тяжелых форм инфекций, вызванных инкапсулированными возбудителями (в т. ч. менингококком) [2, 4, 9, 12, 13, 16, 17, 24, 27].
В связи с этим на все инкапсулированные бактерии, к которым относятся и менингококки, не формируется долгосрочный и стойкий иммунитет. Высказывается предположение, что у детей раннего возраста это усугубляется еще и незрелостью В-лимфоцитов, что приводит к крайне низкой активности иммунного ответа и обусловливает высокую восприимчивость данного контингента к инкапсулированным возбудителям (менингококк, пневмококк, Hib и др.), частое развитие при этом инвазивных форм заболевания со значительным уровнем неблагоприятных исходов. С учетом того, что распознавание Т-независимых АГ происходит в краевой зоне селезенки (над мантией), где сконцентрированы специализированные макрофаги и В-лимфоциты, отвечающие на Т-независимые АГ, становится понятным, почему пациенты с аспленией (анатомической и функциональной) относятся к группе высокого риска по развитию тяжелых форм инфекций, вызванных инкапсулированными возбудителями (в т. ч. менингококком) [2, 4, 9, 12, 13, 16, 17, 24, 27].
Расшифровка особенностей иммунного реагирования на Т-независимые АГ определила научный поиск методов, с помощью которых указанные АГ смогли бы распознаваться Т-лимфоцитами.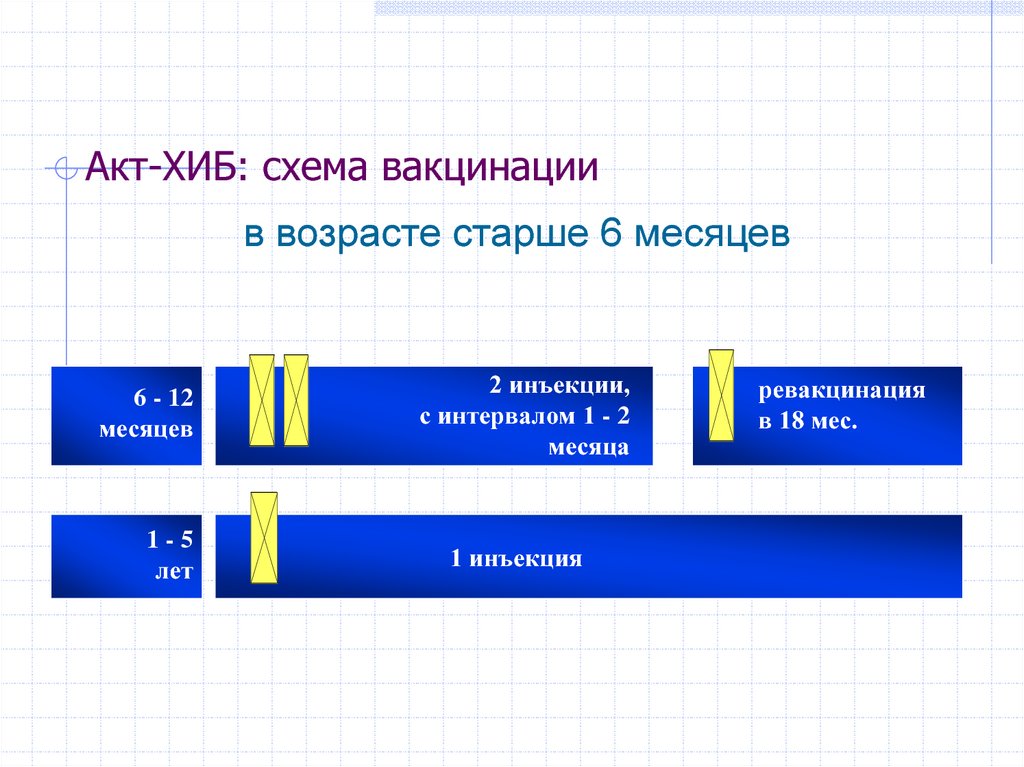 Оказалось, что в тех случаях, когда Т-независимые АГ соединены (конъюгированы) с белком-носителем, происходит активация Т-клеток, формируется полноценный иммунный ответ. Благодаря этому открытию были созданы конъюгированные вакцины против инкапсулированных возбудителей (менингококковая, пневмококковая, Hib), которые с успехом стали применяться у младенцев и детей раннего возраста. При этом если Hib и пневмококковая конъюгированные вакцины уже вошли в отечественный арсенал прививок, то до последнего времени в России не были представлены конъюгированные менингококковые вакцины. Первой 4-валентной конъюгированной менингококковой вакциной, зарегистрированной в РФ, является комбинированная конъюгированная вакцина Менактра («Санофи Пастер», подразделение вакцин Группы «Санофи», Франция) [3].
Оказалось, что в тех случаях, когда Т-независимые АГ соединены (конъюгированы) с белком-носителем, происходит активация Т-клеток, формируется полноценный иммунный ответ. Благодаря этому открытию были созданы конъюгированные вакцины против инкапсулированных возбудителей (менингококковая, пневмококковая, Hib), которые с успехом стали применяться у младенцев и детей раннего возраста. При этом если Hib и пневмококковая конъюгированные вакцины уже вошли в отечественный арсенал прививок, то до последнего времени в России не были представлены конъюгированные менингококковые вакцины. Первой 4-валентной конъюгированной менингококковой вакциной, зарегистрированной в РФ, является комбинированная конъюгированная вакцина Менактра («Санофи Пастер», подразделение вакцин Группы «Санофи», Франция) [3].
Менактра — это комбинированная конъюгированная менингококковая вакцина, содержащая капсульные полисахариды Neisseria meningitidis серотипов A, C, Y, W-135, которые индивидуально конъюгированы с белком-носителем (очищенный анатоксин Corynebacterium diphtheriae) [3]. В ходе 28 исследований, проведенных у 46 381 человек, в т. ч. 3824 младенцев и детей в возрасте 1–2 лет, были получены убедительные данные о безопасности и эффективности вакцины Менактра как у взрослых, так и у детей разных возрастных категорий [28]. Так, установлено, что при использовании вакцины Менактра у младенцев в возрасте 9 мес. с последующим введением 2-й дозы через 3 мес. у подавляющего большинства привитых были выявлены защитные титры антител к менингококкам серогрупп A, C, Y, W-135 в отличие от детей, иммунизированных полисахаридной вакциной, содержащей те же серотипы Neisseria meningitidis. Было также отмечено, что Менактра у детей в возрасте 2–5 и 6–10 лет индуцирует значительно более высокий титр антител по сравнению с полисахаридной вакциной. У подростков прививка Менактра показала высокую иммунологическую эффективность, сопоставимую с эффективностью полисахаридной вакцины. При этом у 71% подростков, привитых вакциной Менактра, через 3 года после иммунизации сохранялись защитные титры антител к менингококкам серогрупп A, C, Y, W-135.
В ходе 28 исследований, проведенных у 46 381 человек, в т. ч. 3824 младенцев и детей в возрасте 1–2 лет, были получены убедительные данные о безопасности и эффективности вакцины Менактра как у взрослых, так и у детей разных возрастных категорий [28]. Так, установлено, что при использовании вакцины Менактра у младенцев в возрасте 9 мес. с последующим введением 2-й дозы через 3 мес. у подавляющего большинства привитых были выявлены защитные титры антител к менингококкам серогрупп A, C, Y, W-135 в отличие от детей, иммунизированных полисахаридной вакциной, содержащей те же серотипы Neisseria meningitidis. Было также отмечено, что Менактра у детей в возрасте 2–5 и 6–10 лет индуцирует значительно более высокий титр антител по сравнению с полисахаридной вакциной. У подростков прививка Менактра показала высокую иммунологическую эффективность, сопоставимую с эффективностью полисахаридной вакцины. При этом у 71% подростков, привитых вакциной Менактра, через 3 года после иммунизации сохранялись защитные титры антител к менингококкам серогрупп A, C, Y, W-135. Кроме этого, было установлено, что после ревакцинации этих подростков через 3 года напряженность иммунитета к указанным возбудителям была значительно выше в группе привитых Менактрой по сравнению с таким же показателем у привитых полисахаридной вакциной. Особо были отмечены хорошая переносимость и безопасность вакцины. Постмаркетинговое наблюдение в течение 9 лет от начала применения вакцины Менактра во многих странах мира (использовано более 74 млн доз) также подтвердило высокий профиль ее безопасности [28].
Кроме этого, было установлено, что после ревакцинации этих подростков через 3 года напряженность иммунитета к указанным возбудителям была значительно выше в группе привитых Менактрой по сравнению с таким же показателем у привитых полисахаридной вакциной. Особо были отмечены хорошая переносимость и безопасность вакцины. Постмаркетинговое наблюдение в течение 9 лет от начала применения вакцины Менактра во многих странах мира (использовано более 74 млн доз) также подтвердило высокий профиль ее безопасности [28].
В России в отличие от других стран вакцина Менактра была зарегистрирована для использования у лиц в возрасте от 2 до 55 лет. С учетом особой актуальности борьбы с МИ у детей раннего возраста в РФ было проведено предрегистрационное многоцентровое открытое клиническое исследование для оценки иммуногенности и безопасности 4-валентной (A, C, Y, W-135) менингококковой конъюгированной вакцины Менактра у детей в возрасте 9–23 мес. В многоцентровое открытое клиническое исследование было включено 100 детей в возрасте 9–23 мес. , проживающих в Екатеринбурге, Санкт-Петербурге, Перми и Мурманске. Исследование ставило своей целью оценить удельный вес детей с защитным уровнем антител (≥1:8) среди привитых и выраженность иммунного ответа через 1 мес. после законченного курса вакцинации 2-мя дозами вакцины Менактра с интервалом 3–6 мес., а также профиль безопасности вакцины после каждой вакцинации. Итоги исследования были доложены на XVIII конгрессе педиатров России (12—15 февраля 2015 г.). Анализ результатов исследования показал, что через 1 мес. после окончания иммунизации (2-кратное введение вакцины Менактра с интервалом между введением 3–6 мес.) у 93–99% детей наблюдался высокий уровень антител к менингококкам серогрупп A, C, Y, W. Установлено, что вакцинация приводила к нарастанию концентрации антител ко всем 4 серогруппам менингококка до протективных уровней, независимо от их исходных значений. В ходе наблюдения была подтверждена безопасность вакцины. Результаты исследования, проведенного в РФ, соответствуют данным о безопасности и иммуногенности Менактры, полученным ранее в других странах у детей в аналогичных возрастных группах.
, проживающих в Екатеринбурге, Санкт-Петербурге, Перми и Мурманске. Исследование ставило своей целью оценить удельный вес детей с защитным уровнем антител (≥1:8) среди привитых и выраженность иммунного ответа через 1 мес. после законченного курса вакцинации 2-мя дозами вакцины Менактра с интервалом 3–6 мес., а также профиль безопасности вакцины после каждой вакцинации. Итоги исследования были доложены на XVIII конгрессе педиатров России (12—15 февраля 2015 г.). Анализ результатов исследования показал, что через 1 мес. после окончания иммунизации (2-кратное введение вакцины Менактра с интервалом между введением 3–6 мес.) у 93–99% детей наблюдался высокий уровень антител к менингококкам серогрупп A, C, Y, W. Установлено, что вакцинация приводила к нарастанию концентрации антител ко всем 4 серогруппам менингококка до протективных уровней, независимо от их исходных значений. В ходе наблюдения была подтверждена безопасность вакцины. Результаты исследования, проведенного в РФ, соответствуют данным о безопасности и иммуногенности Менактры, полученным ранее в других странах у детей в аналогичных возрастных группах. Результаты российского клинического исследования позволили «Санофи Пастер», подразделению вакцин Группы «Санофи», подать на регистрацию новое возрастное показание для 4-валентной менингококковой конъюгированной вакцины Менактра — с 9 до 23 мес. с 2-кратной иммунизацией. Компания ожидает получения регистрации нового возрастного показания до июня 2015 г. [6].
Результаты российского клинического исследования позволили «Санофи Пастер», подразделению вакцин Группы «Санофи», подать на регистрацию новое возрастное показание для 4-валентной менингококковой конъюгированной вакцины Менактра — с 9 до 23 мес. с 2-кратной иммунизацией. Компания ожидает получения регистрации нового возрастного показания до июня 2015 г. [6].
Таким образом, появление в России 4-валентной менингококковой конъюгированной вакцины Менактра открывает новые возможности эффективного предупреждения МИ у детей, в т. ч. первых лет жизни.
Вакцины против менингита | Meningitis Research Foundation
- Конъюгированная вакцина против Hib (сделанная из крошечного фрагмента сахарной оболочки бактерии, прикрепленной к белку) была введена в Великобритании и Ирландии в 1992 г. и обеспечивает длительный иммунитет.
- С момента внедрения Hib-вакцины заболеваемость менингитом, вызванным Haemophilus influenzae, снизилась более чем на 90% в Великобритании и Ирландии 1,2 .

- Внедрение конъюгированной Hib-вакцины также снизило уровень бактерионосительства.
- До того, как была введена вакцина, большая часть детей в возрасте до 5 лет были носителями бактерий. Теперь, когда вакцинация стала рутинной, бактерионосительство встречается гораздо реже, и в результате защита распространяется на остальную часть населения, даже на тех, кто не был иммунизирован. Это называется «коллективный иммунитет».
Безопасна ли вакцина Hib?
Миллионы доз, введенных детям во всем мире за более чем десятилетие, установили отличные показатели безопасности. Побочные реакции встречаются не чаще, чем для других вакцин, которые обычно вводят младенцам и детям. Hib-вакцина не является живой вакциной и не может вызвать даже очень легкую форму заболевания.
Кто получает Hib-вакцину?
В настоящее время в Соединенном Королевстве вакцина предлагается детям в возрасте 2, 3 и 4 месяцев в рамках программы плановой иммунизации, а повторная вакцинация против Hib (вводится в виде комбинации Hib/MenC) предлагается в возрасте 12–13 месяцев.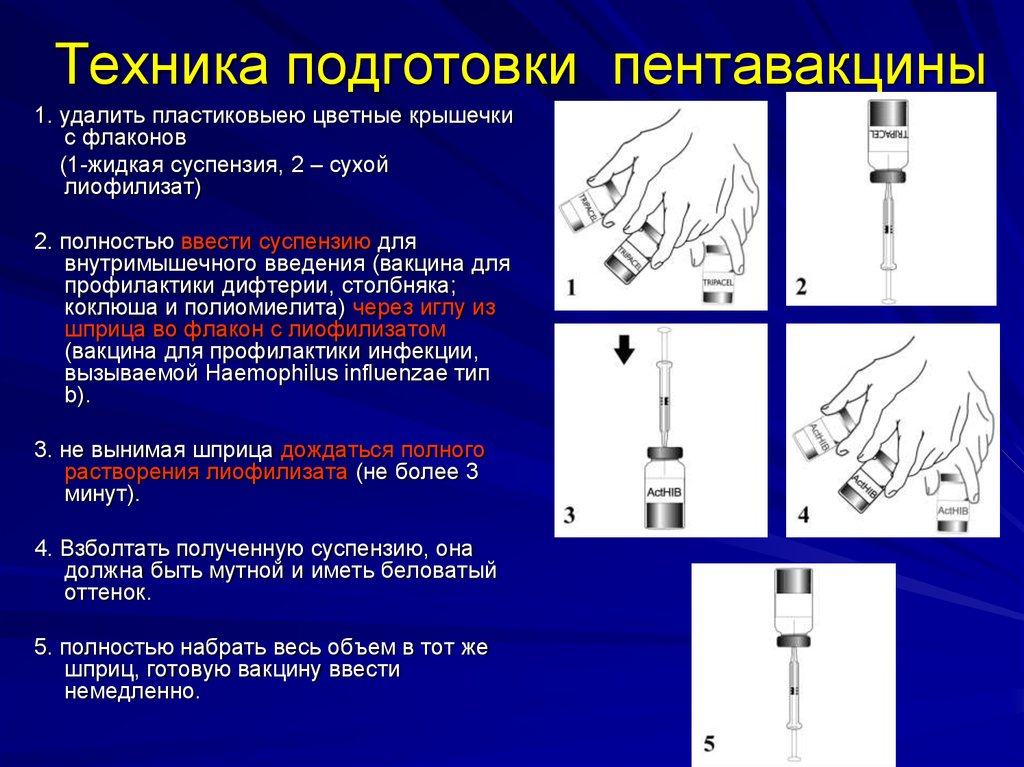
Кроме того, в Великобритании Hib-вакцина рекомендуется для детей старшего возраста и взрослых с определенными иммунодефицитами, например, для людей с ВИЧ или с отсутствием функционирующей селезенки (асплены и гипосплены), включая людей с серповидно-клеточным расстройством 4 .
В настоящее время в Ирландии вакцина предлагается детям в возрасте 2, 4 и 6 месяцев в рамках программы плановой иммунизации, а бустерная доза Hib предлагается в возрасте 12 месяцев.
Помимо младенцев, в Ирландии вакцина против Hib рекомендуется для всех детей в возрасте до четырех лет, которые ранее не получали вакцину, а также для всех с нарушением функции или отсутствием селезенки, серповидно-клеточной анемией, ВИЧ или другим иммунодефицитом, независимо от сколько им лет 5 .
Является ли Hib по-прежнему важной причиной менингита?
Hib-вакцина очень эффективна, но ни одна вакцина не эффективна на 100%. Это не работает у детей с определенными проблемами с иммунитетом. Кроме того, очень небольшая часть совершенно здоровых детей недостаточно хорошо реагирует на вакцину, чтобы защититься от гемофильного менингита. Взрослые и дети старшего возраста редко бывают восприимчивы к Hib-инфекции, но известны случаи, особенно у госпитализированных, больных и пожилых пациентов. Заболевания, вызванные не-b типами Haemophilus influenzae, также находятся под наблюдением.
Кроме того, очень небольшая часть совершенно здоровых детей недостаточно хорошо реагирует на вакцину, чтобы защититься от гемофильного менингита. Взрослые и дети старшего возраста редко бывают восприимчивы к Hib-инфекции, но известны случаи, особенно у госпитализированных, больных и пожилых пациентов. Заболевания, вызванные не-b типами Haemophilus influenzae, также находятся под наблюдением.
Иммунизация резко сократила случаи менингита, вызванного Hib, но в странах, которые не внедрили вакцину, Hib по-прежнему является основной причиной серьезных заболеваний у детей.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобряет расширенное использование вакцины GSK Hib от ревакцинации до полной серии
- Перейти к содержимому
- Перейти к поиску
Выдан: Philadelphia
Компания GSK [LSE/NYSE: GSK] объявила сегодня, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило расширенное указание возраста для HIBERIX 9. 0009 ® [Конъюгированная вакцина против Haemophilus b (конъюгат столбнячного анатоксина)]. HIBERIX ® в настоящее время показан для иммунизации детей в возрасте от шести недель до четырех лет (до 5 900 10 лет) против инвазивного заболевания, вызываемого Haemophilus influenzae типа b (Hib). Hib-инфекция — это серьезное заболевание, вызываемое бактериями, обычно поражающее детей в возрасте до пяти лет, и вакцинация против Hib для соответствующих детей обычно рекомендуется.
0009 ® [Конъюгированная вакцина против Haemophilus b (конъюгат столбнячного анатоксина)]. HIBERIX ® в настоящее время показан для иммунизации детей в возрасте от шести недель до четырех лет (до 5 900 10 лет) против инвазивного заболевания, вызываемого Haemophilus influenzae типа b (Hib). Hib-инфекция — это серьезное заболевание, вызываемое бактериями, обычно поражающее детей в возрасте до пяти лет, и вакцинация против Hib для соответствующих детей обычно рекомендуется.
«Получив это разрешение, GSK теперь может предложить пациентам, врачам и общественному здравоохранению более полный портфель педиатрических вакцин в США для детей до 18 месяцев», — сказал Патрик Десбьенс, старший вице-президент и глава отдела вакцин США. ГСК. «Хотя мы были рады, что HIBERIX ® был впервые одобрен в качестве бустерной дозы для решения проблемы с поставками в США, теперь, когда одобрена вся серия, мы завершаем эту главу».
Оценка эффективности HIBERIX ® была основана на иммунных реакциях у детей с использованием серологических конечных точек, предсказывающих защиту от инвазивного заболевания, вызванного Hib. В ходе клинических испытаний частыми нежелательными явлениями (≥20%) были боль и покраснение в месте инъекции, раздражительность, сонливость, лихорадка, потеря аппетита, суетливость и беспокойство. Отсутствуют клинические данные контролируемых исследований, сравнивающих бустерную иммунизацию с HIBERIX 9.0009 ® и лицензированную в США конъюгированную Hib-вакцину.
В ходе клинических испытаний частыми нежелательными явлениями (≥20%) были боль и покраснение в месте инъекции, раздражительность, сонливость, лихорадка, потеря аппетита, суетливость и беспокойство. Отсутствуют клинические данные контролируемых исследований, сравнивающих бустерную иммунизацию с HIBERIX 9.0009 ® и лицензированную в США конъюгированную Hib-вакцину.
«Hib — это серьезное инвазивное бактериальное заболевание, которое можно предотвратить с помощью вакцинации», — сказал д-р Леонард Фридланд, вице-президент/директор по научным вопросам и общественному здравоохранению, GSK Vaccines, Северная Америка. «HIBERIX ® предоставляет поставщикам медицинских услуг и пациентам еще один вариант Hib для защиты от серьезного детского инфекционного заболевания».
В 2009 году органы здравоохранения и GSK совместно работали над выпуском HIBERIX 9.0009 ® в США в качестве бустерной дозы для восполнения нехватки поставок, и он использовался до тех пор, пока уровни поставок для всей серии не вернулись к норме. Центры США по контролю и профилактике заболеваний (CDC) рекомендуют следующий график вакцинации против Hib:
Центры США по контролю и профилактике заболеваний (CDC) рекомендуют следующий график вакцинации против Hib:
- Первая доза: в возрасте 2 месяцев
- Вторая доза: в возрасте 4 месяцев
- Третья доза: в возрасте 6 месяцев (при необходимости, в зависимости от типа вакцины)
- Окончательная бустерная доза: в возрасте 12–15 месяцев (*Примечание: показания HIBERIX для бустерной дозы — 15–18 месяцев)
HIBERIX ® был впервые лицензирован за пределами США в 1996 году и одобрен в 78 странах мира. На сегодняшний день GSK поставила около 210 миллионов доз HIBERIX ® по всему миру. Полная инструкция по применению препарата HIBERIX ® в США для расширенного показания будет доступна на сайте https://www.gsksource.com/hiberix через несколько дней. Электронная копия предоставляется по запросу.
О Hib[1]
Гемофильная инфекция типа b (Hib) — это серьезное заболевание, вызываемое бактериями. Обычно от него страдают дети в возрасте до 5 лет. Бактерии передаются от человека к человеку, и если они достигают легких или кровотока, бактерии становятся инвазивными и могут вызвать серьезные проблемы, такие как бактериальный менингит. Менингит — это инфекция оболочки головного или спинного мозга, которая может привести к повреждению головного мозга или глухоте.
Обычно от него страдают дети в возрасте до 5 лет. Бактерии передаются от человека к человеку, и если они достигают легких или кровотока, бактерии становятся инвазивными и могут вызвать серьезные проблемы, такие как бактериальный менингит. Менингит — это инфекция оболочки головного или спинного мозга, которая может привести к повреждению головного мозга или глухоте.
До введения Hib-вакцины в 1985 г. Hib была основной причиной бактериального менингита у детей в возрасте до 5 лет в США. Приблизительно 20 000 детей в США в возрасте до 5 лет заражались Hib-инфекцией каждый год, и примерно 3-6% из них погибли. С момента внедрения Hib-вакцины число случаев инвазивной Hib-инфекции сократилось более чем на 99%.
Показания и важная информация по безопасности для HIBERIX
HIBERIX — это вакцина, предназначенная для активной иммунизации для предотвращения инвазивного заболевания, вызванного Haemophilus influenzae типа b. HIBERIX одобрен для использования у детей в возрасте от 6 недель до 4 лет (до пятилетнего возраста).
Отсутствуют клинические данные контролируемых исследований, сравнивающих бустерную иммунизацию с помощью HIBERIX и конъюгированной вакцины против Haemophilus b, лицензированной в США.
- Тяжелая аллергическая реакция (например, анафилаксия) после предыдущей дозы любой вакцины, содержащей H. influenzae типа b или столбнячного анатоксина, или любого компонента HIBERIX является противопоказанием для введения HIBERIX
- Если синдром Гийена-Барре развился в течение 6 недель после получения предыдущей вакцины, содержащей столбнячный анатоксин, решение о введении HIBERIX должно основываться на рассмотрении потенциальных преимуществ и возможных рисков
- Обморок (обморок) может возникнуть в связи с введением инъекционных вакцин, включая HIBERIX. Должны быть предусмотрены процедуры, чтобы избежать травм при падении и восстановить церебральную перфузию после обморока
- Апноэ после внутримышечной вакцинации наблюдалось у некоторых недоношенных детей.