Содержание
ПАМЯТКА. ЭНТЕРОВИРУСНАЯ ИНФЕКЦИЯ — Бюджетное учреждение Ханты-Мансийского автономного округа — Югры
ПАМЯТКА. ЭНТЕРОВИРУСНАЯ ИНФЕКЦИЯ
Энтеровирусные инфекции — это группа острых инфекционных болезней, вызываемых кишечными вирусами (энтеровирусами), характеризующаяся лихорадкой и многообразными клиническими симптомами.
Энтеровирусы (их более 80 типов) довольно быстро погибают при температурах свыше 50°С (при 60°С — за 6-8 мин., при 100°С — мгновенно), быстро разрушаются под воздействием хлорсодержащих препаратов, ультрафиолетового облучения, при высушивании, кипячении. Тем не менее, при температуре 37°С вирусы могут сохранять жизнеспособность в течение 50-65 дней, длительно сохраняются в воде. В замороженном состоянии активность энтеровирусов сохраняется в течение многих лет, при хранении в обычном холодильнике (+4° — +6°С) — в течение нескольких недель, а при комнатной температуре — на протяжении нескольких дней. Они выдерживают многократное замораживание и оттаивание без потери активности. Резервуаром и источником инфекции является больной человек или инфицированный бессимптомный носитель вируса.
Они выдерживают многократное замораживание и оттаивание без потери активности. Резервуаром и источником инфекции является больной человек или инфицированный бессимптомный носитель вируса.
Наиболее интенсивное выделение возбудителя происходит в первые дни болезни. Доказана высокая контагиозность (заразность) энтеровирусов.
Вирус обнаруживают в крови, моче, носоглотке и фекалиях за несколько дней до появления клинических симптомов; инфицированные лица наиболее опасны для окружающих в ранние периоды инфекции, когда возбудитель выделяется из организма в наибольших концентрациях.
Инкубационный (скрытый) период энтеровирусной инфекции варьируется от 2 — х до 35 дней, в среднем — до 2 — х недель.
Источником инфекции является только человек. Инфекция передается воздушно-капельным (от больных), контактно-бытовым (от вирусоносителей), пищевым и водным путями. Заболевание распространено повсеместно. В странах умеренного климата характерна сезонность с повышением заболеваемости в конце лета и в начале осени. Заболевают преимущественно дети и лица молодого возраста. Заболевания наблюдаются в виде спорадических случаев, локальных вспышек (чаще в детских коллективах) и в виде крупных эпидемий, поражающих отдельные регионы и даже страны.
Заболевают преимущественно дети и лица молодого возраста. Заболевания наблюдаются в виде спорадических случаев, локальных вспышек (чаще в детских коллективах) и в виде крупных эпидемий, поражающих отдельные регионы и даже страны.
Факторами передачи инфекции служат вода, овощи, загрязненные энтеровирусами в результате применения необезвреженных сточных вод при их поливке. Также вирус может передаваться через грязные руки, игрушки и другие объекты внешней среды.
Человек, в организм которого проник энтеровирус, чаще становится носителем, или переносит заболевание в легкой форме. Около 85% случаев заболеваний протекает бессимптомно, в 12-14% диагностируются легкие формы заболевания, и только 1-3% имеют тяжелое течение. Особую опасность энтеровирусные инфекции представляют для лиц со сниженным иммунитетом.
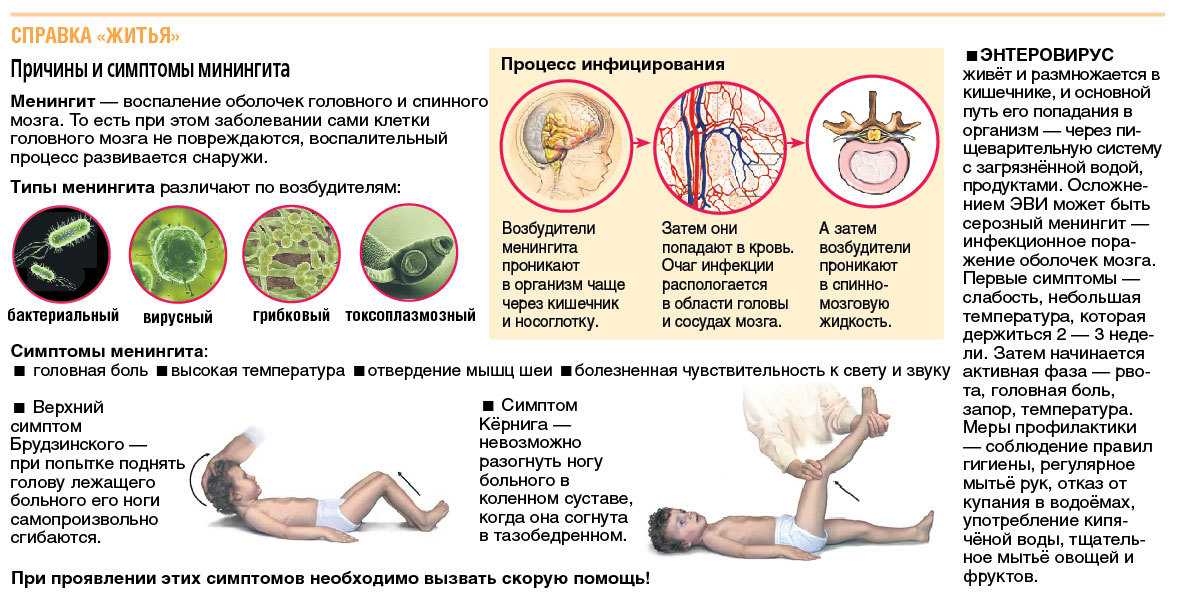
Способность энтеровирусов воздействовать на многие органы человека вызывает большое разнообразие клинических форм инфекции. Могут поражаться практически все органы и ткани организма: нервная, сердечно-сосудистая и бронхолегочная системы, желудочно-кишечный тракт, а также почки, глаза, мышцы, кожа, слизистая полости рта, печень, эндокринные органы. Одним из наиболее серьезных и нередко регистрируемых форм энтеровирусной инфекции является серозный менингит, характеризующийся сильной головной болью, повышением температуры до 38-39°С, болями в затылочных мышцах, светобоязнью, рвотой.
Одним из наиболее серьезных и нередко регистрируемых форм энтеровирусной инфекции является серозный менингит, характеризующийся сильной головной болью, повышением температуры до 38-39°С, болями в затылочных мышцах, светобоязнью, рвотой.
Методы специфической профилактики (вакцинация) против энтеровирусных инфекций не разработаны. Однако одним из методов борьбы с энтеровирусными инфекциями является вакцинация против полиомиелита, так как вакцинный штамм вируса обладает подавляющим действием на энтеровирус. Поэтому следует обязательно прививаться в рамках национального календаря прививок, в который включена иммунизация против полиомиелита.
Меры неспецифической профилактики энтеровирусной инфекции — 5 простых правил профилактики кишечных инфекций:
1. для питья использовать только кипяченую или бутилированную воду;
2. мыть руки с мылом перед каждым приемом пищи и после каждого посещения туалета, строго соблюдать правила личной и общественной гигиены;
3. перед употреблением фруктов, овощей, их необходимо тщательно мыть с применением щетки и последующим ополаскиванием кипятком;
перед употреблением фруктов, овощей, их необходимо тщательно мыть с применением щетки и последующим ополаскиванием кипятком;
4. купаться только в официально разрешенных местах, при купании стараться не заглатывать воду;
5. не приобретать продукты у частных лиц, в неустановленных для торговли местах.
При первых признаках заболевания необходимо немедленно обращаться за медицинской помощью, не заниматься самолечением.
ЭНТЕРОВИРУСНАЯ ИНФЕКЦИЯ. СЕРОЗНЫЙ МЕНИНГИТ
Энтеровирусная инфекция (серозный менингит) — вирусное инфекционное заболевание, характеризующееся лихорадкой, сильными головными болями, рвотой.
Возбудитель и пути передачи инфекции.
Вызывается серозный менингит энтеровирусами (кишечными). Вирус устойчив во внешней среде.
Источником инфекции является больной человек и «здоровый» вирусоноситель.
Вирус передается через воду, овощи, фрукты, пищевые продукты, грязные руки. Заражение чаще происходит при купании в водоемах и плавательных бассейнах, употреблении некипяченой недоброкачественной воды. В ряде случаев может передаваться и воздушно-капельным путем при большом скоплении людей.
Заражение чаще происходит при купании в водоемах и плавательных бассейнах, употреблении некипяченой недоброкачественной воды. В ряде случаев может передаваться и воздушно-капельным путем при большом скоплении людей.
Наиболее часто поражаются дети от 3-х до 6 лет, у детей школьного возраста восприимчивость к данным вирусам снижается, а взрослые болеют редко. Характерна летне-осенняя сезонность заболеваемости.
Клиническая картина.
Начало болезни, как правило, острое: повышение температуры до 38 — 40 градусов, головная боль, возможны рвота, мышечные боли, понос. Нередко бывают боли в животе, общее беспокойство, иногда бред, судороги. Через 3-7 дней температура снижается и к 5 — 7 дню симптомы исчезают.
Что делать если ребенок заболел?
Если у ребенка появилась характерная симптоматика, то необходимо срочно обратиться за медицинской помощью и при необходимости госпитализировать ребенка.
Как избежать заболевания?
- Для питья использовать только кипяченую качественную воду;
- Овощи, фрукты, ягоды употреблять в пищу только после того, как вы их тщательно вымоете и обдадите кипятком;
- Строго соблюдать правила личной гигиены. Мыть руки с мылом перед каждым приемом пищи и после каждого посещения туалета;
- Проветривать помещения;
- Правильное полноценное питание, витаминотерапия, закаливание, активный двигательный режим.
Прогноз.
В большинстве случаев благоприятный. Стационарное лечение продолжается до 2-3 недель.
Мероприятия в очаге инфекции.
За детьми и персоналом, контактировавших с заболевшим, в детских учреждениях устанавливается карантин до 20 дней после прекращения контакта и проведения дезинфекции.
В случае выявления лиц подозрительных на заболевание — проводится их изоляция.
Вводится ограничение проведения массовых мероприятий.
Энтеровирусная инфекция у детей
Энтеровирусные инфекции включают в себя группу заболеваний. Их специфика такова, что после перенесенной инфекции образуется пожизненный иммунитет. Однако иммунитет будет только к тому типу вируса, разновидностью которого переболел ребенок. Поэтому энтеровирусной инфекцией ребенок может болеть несколько раз за свою жизнь. По этой же причине не существует вакцины от данного заболевания.
Болеют чаще всего дети в возрасте от 3 до 10 лет. У детей, находящихся на грудном вскармливании, в организме присутствует иммунитет, полученный от матери через грудное молоко, однако, этот иммунитет не стойкий и после прекращения грудного вскармливания быстро исчезает.
Вирус передается от больного ребенка или от ребенка, который является вирусоносителем. Вирусы хорошо сохраняются в воде и почве, при замораживании могут выживать на протяжении нескольких лет, устойчивы к действию дезинфицирующих средств, однако восприимчивы к действию высоких температур (при нагревании до 45ºС погибают через 45-60 секунд).
Пути передачи вируса:
— воздушно-капельный (при чихании и кашле с капельками слюны от больного ребенка к здоровому)
— фекально-оральный при не соблюдении правил личной гигиены
— через воду, при употреблении сырой (не кипяченой) воды
— возможно заражение детей через игрушки, если дети их берут в рот
Симптомы энтеровирусной инфекции
У энтеровирусных инфекций есть как схожие проявления, так и различные, в зависимости от вида. Попав в организм ребенка, вирусы мигрируют в лимфатические узлы, где они оседают и начинают размножаться. Инкубационный период у всех энтеровирусных инфекций одинаковый – от 1 до 10 дней (чаще 2-5 дней).
Заболевание начинается остро — с повышения температуры тела до 38-39º С. Температура чаще всего держится 3-5 дней, после чего снижается до нормальных цифр. Очень часто температура имеет волнообразное течение: 2-3 дня держится температура, после чего снижается и 2-3 дня находится на нормальных цифрах, затем снова поднимается на 1-2 дня и вновь нормализуется уже окончательно. При повышении температуры ребенок ощущает слабость, сонливость, может наблюдаться головная боль, тошнота, рвота. При снижении температуры тела все эти симптомы проходят, однако при повторном повышении могут вернуться. Также увеличиваются шейные и подчелюстные лимфоузлы, так как в них происходит размножение вирусов.
При повышении температуры ребенок ощущает слабость, сонливость, может наблюдаться головная боль, тошнота, рвота. При снижении температуры тела все эти симптомы проходят, однако при повторном повышении могут вернуться. Также увеличиваются шейные и подчелюстные лимфоузлы, так как в них происходит размножение вирусов.
В зависимости от того, какие органы больше всего поражаются, выделяют несколько форм энтеровирусной инфекции. Энтеровирусы могут поражать: центральную и периферическую нервные системы, слизистую ротоглотки, слизистую глаз, кожу, мышцы, сердце, слизистую кишечника, печень, у мальчиков возможно поражение яичек.
Наиболее тяжелое последствие энтеровируса – это развитие серозного энтеровирусного менингита. Он может развиться у ребенка любого возраста и распознается по следующим признакам:
— головная боль разлитого характера, интенсивность которой нарастает с каждым часом;
— рвота без тошноты, после которой ребенок не ощущает облегчения;
— усиление боли и повторный эпизод рвоты может быть спровоцирован ярким светом или громким звуком;
— ребенок может быть заторможен или, наоборот, чрезвычайно возбужден;
— в тяжелых случаях развиваются судороги всех мышечных групп;
Окончательный диагноз менингита может поставить только доктор после проведения люмбальной пункции и изучения лабораторных показателей полученной спинномозговой жидкости.
Лечение энтеровирусной инфекции
Специфического лечения энтеровирусной инфекции не существует. Лечение проводят в домашних условиях, госпитализация показана при наличии поражения нервной системы, сердца, высокой температуры, которая долго не поддается снижению при использовании жаропонижающих средств. Ребенку показан постельный режим на весь период повышения температуры тела.
Питание должно быть легким, богатым белками. Необходимо достаточное количество жидкости: кипяченая вода, минеральная вода без газов, компоты, соки, морсы.
Лечение проводят симптоматически в зависимости от проявлений инфекции. В некоторых случаях (ангина, понос, конъюнктивит) проводят профилактику бактериальных осложнений.
Дети изолируются на весь период заболевания. В детском коллективе могут находиться после исчезновения всех симптомов заболевания.
Профилактика энтеровирусной инфекции
Для профилактики необходимо соблюдение правил личной гигиены: мыть руки после посещения туалета, прогулки на улице, пить только кипяченую воду или воду из заводской бутылки, недопустимо использование для питья ребенка воды из открытого источника (река, озеро).
Специфической вакцины против энтеровирусной инфекции не существует, так как в окружающей среде присутствует большое количество серотипов этих вирусов.
ВАЖНО при первых признаках заболевания обращаться к врачу, которые определит тактику лечения!
Обоснование энтеровирусной вакцинации и противовирусной терапии при диабете 1 типа у человека
1. Гундерсен Э. Является ли диабет инфекционного происхождения? J заразить дис. 1927; 41:1975–1979. [Google Scholar]
2. Родригес-Кальво Т., Сабури С., Анкетиль Ф., фон Херрат М.Г. Вирусная парадигма диабета 1 типа: кто главные подозреваемые? Аутоиммун Рев. 2016;15(10):964–969. doi: 10.1016/j.autrev.2016.07.019. [PubMed] [CrossRef] [Google Scholar]
3. Gamble DR, Taylor KW. Сезонная заболеваемость сахарным диабетом. Бр Мед Дж. 1969;3(5671):631–633. doi: 10.1136/bmj.3.5671.631. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Gamble DR, Taylor KW, Cumming H. Вирусы Коксаки и сахарный диабет. Br Med J. 1973;4(5887):260–262. doi: 10.1136/bmj.4.5887.260. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Br Med J. 1973;4(5887):260–262. doi: 10.1136/bmj.4.5887.260. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Lee HS, Briese T, Winkler C, et al. Секвенирование вирусов нового поколения у детей с быстроразвивающимся диабетом 1 типа. Диабетология. 2013;56(8):1705–1711. doi: 10.1007/s00125-013-2924-й. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Stene LC, Oikarinen S, Hyoty H, et al. Энтеровирусная инфекция и прогрессирование от островкового аутоиммунитета до диабета 1 типа: диабет и аутоиммунное исследование у молодых (DAISY) диабета. 2010;59(12):3174–3180. doi: 10.2337/db10-0866. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Ashton MP, Eugster A, Walther D, et al. Неполный иммунный ответ на вирусы Коксаки В ассоциируется с ранним аутоиммунитетом против инсулина. Научный доклад 2016; 6 (1): 32899. doi: 10.1038/srep32899. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Salminen K, Sadeharju K, Lonnrot M, et al. Энтеровирусные инфекции связаны с индукцией аутоиммунитета бета-клеток в проспективном исследовании когорты новорожденных. J Med Virol. 2003;69(1):91–98. doi: 10.1002/jmv.10260. [PubMed] [CrossRef] [Google Scholar]
Энтеровирусные инфекции связаны с индукцией аутоиммунитета бета-клеток в проспективном исследовании когорты новорожденных. J Med Virol. 2003;69(1):91–98. doi: 10.1002/jmv.10260. [PubMed] [CrossRef] [Google Scholar]
9. Hyoty H. Вирусы при диабете 1 типа. Педиатр Диабет. 2016; 17 (Приложение 22): 56–64. doi: 10.1111/pedi.12370. [PubMed] [CrossRef] [Академия Google]
10. Lin HC, Wang CH, Tsai FJ, et al. Энтеровирусная инфекция связана с повышенным риском детского диабета 1 типа на Тайване: общенациональное популяционное когортное исследование. Диабетология. 2015;58(1):79–86. doi: 10.1007/s00125-014-3400-z. [PubMed] [CrossRef] [Google Scholar]
11. Allen DW, Kim KW, Rawlinson WD, Craig ME. Материнские вирусные инфекции во время беременности и диабет 1 типа у их потомства: систематический обзор и метаанализ обсервационных исследований. Преподобный Мед Вирол. 2018;28(3):e1974. doi: 10.1002/rmv.1974. [PubMed] [CrossRef] [Google Scholar]
12. Honkanen H, Oikarinen S, Nurminen N, et al. Обнаружение энтеровирусов в стуле на несколько месяцев предшествует островковому аутоиммунитету: возможное свидетельство медленно действующих механизмов вирус-индуцированного аутоиммунитета. Диабетология. 2017;60(3):424–431. doi: 10.1007/s00125-016-4177-z. [PubMed] [CrossRef] [Google Scholar]
Обнаружение энтеровирусов в стуле на несколько месяцев предшествует островковому аутоиммунитету: возможное свидетельство медленно действующих механизмов вирус-индуцированного аутоиммунитета. Диабетология. 2017;60(3):424–431. doi: 10.1007/s00125-016-4177-z. [PubMed] [CrossRef] [Google Scholar]
13. Laitinen OH, Honkanen H, Pakkanen O, et al. Вирус Коксаки B1 связан с индукцией аутоиммунитета β-клеток, что предвещает диабет 1 типа. Диабет. 2014;63(2):446–455. дои: 10.2337/db13-0619. [PubMed] [CrossRef] [Google Scholar]
14. Смит Дебора Дж., Купер Джейсон Д., Бейли Ребекка, Филд Сара, Беррен Оливер, Сминк Люк Дж., Гуджа Кристиан, Ионеску-Тирговисте Константин, Видмер Барри, Дангер Дэвид Б., Savage David A, Walker Neil M, Clayton David G, Todd John A. Полногеномное исследование ассоциации несинонимичных SNP идентифицирует локус диабета 1 типа в области интерферон-индуцированной хеликазы (IFIh2). Генетика природы. 2006;38(6):617–619. doi: 10.1038/ng1800. [PubMed] [CrossRef] [Академия Google]
15. Domsgen E, Lind K, Kong L, et al. Полиморфизм гена IFIh2, связанный с риском аутоиммунитета, регулирует канонические пути противовирусной защиты в островках поджелудочной железы человека, инфицированных вирусом Коксаки. Научный доклад 2016; 6 (1): 39378. doi: 10.1038/srep39378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Domsgen E, Lind K, Kong L, et al. Полиморфизм гена IFIh2, связанный с риском аутоиммунитета, регулирует канонические пути противовирусной защиты в островках поджелудочной железы человека, инфицированных вирусом Коксаки. Научный доклад 2016; 6 (1): 39378. doi: 10.1038/srep39378. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Richardson SJ, Rodriguez-Calvo T, Gerling IC, et al. Гиперэкспрессия островковыми клетками антигенов HLA класса I: определяющая черта диабета 1 типа. Диабетология. 2016;59(11): 2448–2458. doi: 10.1007/s00125-016-4067-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Луни Б.М., Ся CQ, Конканнон П., Остров Д.А., Клэр-Зальцлер М.Дж. Влияние полиморфизмов IFIh2, связанных с диабетом 1 типа, на функцию и экспрессию MDA5. Curr Diab Rep. 2015;15(11):96. doi: 10.1007/s11892-015-0656-8. [PubMed] [CrossRef] [Google Scholar]
18. Колли М.Л., Мур Ф., Гурзов Е.Н., Ортис Ф., Эйзирик Д.Л. MDA5 и PTPN2, два гена-кандидата для диабета 1 типа, модифицируют реакцию бета-клеток поджелудочной железы на двухцепочечную РНК вирусного побочного продукта. Хум Мол Жене. 2010;19(1): 135–146. doi: 10.1093/hmg/ddp474. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Хум Мол Жене. 2010;19(1): 135–146. doi: 10.1093/hmg/ddp474. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Marroqui L, Dos Santos RS, Op de Beeck A, et al. Интерферон-альфа опосредует гиперэкспрессию бета-клеток человека HLA класса I, стресс эндоплазматического ретикулума и апоптоз, три отличительных признака раннего диабета 1 типа у человека. Диабетология. 2017;60(4):656–667. doi: 10.1007/s00125-016-4201-3. [PubMed] [CrossRef] [Google Scholar]
20. Юн Дж.В., Остин М., Онодера Т., Ноткинс А.Л. Выделение вируса из поджелудочной железы ребенка с диабетическим кетоацидозом. N Engl J Med. 1979;300(21):1173–1179. doi: 10.1056/NEJM197905243002102. [PubMed] [CrossRef] [Google Scholar]
21. Dotta F, Censini S, van Halteren AG, et al. Вирусная инфекция Коксаки B4 бета-клеток и инсулит естественных клеток-киллеров у пациентов с недавно возникшим диабетом 1 типа. Proc Natl Acad Sci U S A. 2007;104(12):5115–5120. doi: 10.1073/pnas.0700442104. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
22. Кобаяши Т., Нисида Ю., Танака С., Аида К. Патологические изменения в поджелудочной железе при молниеносном диабете 1 типа и медленно прогрессирующем инсулинозависимом сахарном диабете ( SPIDDM): врожденный иммунитет при фульминантном диабете 1 типа и SPIDDM. Diabetes Metab Res Rev. 2011;27(8):965–970. doi: 10.1002/dmrr.1237. [PubMed] [CrossRef] [Google Scholar]
Кобаяши Т., Нисида Ю., Танака С., Аида К. Патологические изменения в поджелудочной железе при молниеносном диабете 1 типа и медленно прогрессирующем инсулинозависимом сахарном диабете ( SPIDDM): врожденный иммунитет при фульминантном диабете 1 типа и SPIDDM. Diabetes Metab Res Rev. 2011;27(8):965–970. doi: 10.1002/dmrr.1237. [PubMed] [CrossRef] [Google Scholar]
23. Ричардсон С.Дж., Уиллкокс А., Боун А.Дж., Фоулис А.К., Морган Н.Г. Распространенность иммуноокрашивания энтеровирусного капсидного белка vp1 в островках поджелудочной железы при диабете 1 типа у человека. Диабетология. 2009;52(6):1143–1151. doi: 10.1007/s00125-009-1276-0. [PubMed] [CrossRef] [Google Scholar]
24. Richardson SJ, Leete P, Bone AJ, Foulis AK, Morgan NG. Экспрессия энтеровирусного капсидного белка VP1 в островковых клетках пациентов с диабетом 1 типа связана с индукцией протеинкиназы R и подавлением Mcl-1. Диабетология. 2013;56(1):185–193. doi: 10.1007/s00125-012-2745-4. [PubMed] [CrossRef] [Google Scholar]
25. Krogvold L, Edwin B, Buanes T, et al. Выявление низкодифференцированной энтеровирусной инфекции в островках Лангерганса живых больных с впервые выявленным сахарным диабетом 1 типа. Диабет. 2015;64(5):1682–1687. дои: 10.2337/db14-1370. [PubMed] [CrossRef] [Google Scholar]
Krogvold L, Edwin B, Buanes T, et al. Выявление низкодифференцированной энтеровирусной инфекции в островках Лангерганса живых больных с впервые выявленным сахарным диабетом 1 типа. Диабет. 2015;64(5):1682–1687. дои: 10.2337/db14-1370. [PubMed] [CrossRef] [Google Scholar]
26. Krogvold L, Edwin B, Buanes T, et al. Биопсия поджелудочной железы путем минимальной резекции хвоста у живых взрослых пациентов в начале диабета 1 типа: опыт исследования DiViD. Диабетология. 2014;57(4):841–843. doi: 10.1007/s00125-013-3155-y. [PubMed] [CrossRef] [Академия Google]
27. Krogvold L, Genoni A, Puggioni A, et al. Энтеровирус в поджелудочной железе живых взрослых пациентов с впервые диагностированным сахарным диабетом 1 типа. Результаты исследования DiViD. Диабетология. 2017;60:S167. [Google Scholar]
28. Richardson SJ, Leete P, Dhayal S, et al. Оценка достоверности иммуномаркировки, полученной с помощью клона 5D8/1, моноклонального антитела, направленного против энтеровирусного капсидного белка VP1 в поджелудочной железе человека. Диабетология. 2014;57(2):392–401. doi: 10.1007/s00125-013-3094-7. [PubMed] [CrossRef] [Google Scholar]
Диабетология. 2014;57(2):392–401. doi: 10.1007/s00125-013-3094-7. [PubMed] [CrossRef] [Google Scholar]
29. Morgan NG, Richardson SJ. Энтеровирусы как возбудители сахарного диабета 1 типа: незавершенные дела или безнадежное дело? Тенденции Эндокринол Метаб. 2014;25(12):611–619. doi: 10.1016/j.tem.2014.08.002. [PubMed] [CrossRef] [Google Scholar]
30. Чепмен Н.М., Ким К.С. Персистирующая коксакивирусная инфекция: персистенция энтеровируса при хроническом миокардите и дилатационной кардиомиопатии. Курр Топ Микробиол Иммунол. 2008; 323: 275–292. [PubMed] [Академия Google]
31. Tracy S, Smithee S, Alhazmi A, Chapman N. Вирус Коксаки может сохраняться в поджелудочной железе мышей за счет делеции 5′-концевых геномных последовательностей. J Med Virol. 2015;87(2):240–247. doi: 10.1002/jmv.24039. [PubMed] [CrossRef] [Google Scholar]
32. Kim K.-S., Tracy S., Tapprich W., Bailey J., Lee C.-K., Kim K., Barry W. H., Chapman N. M. 5 ‘-Концевые делеции возникают в вирусе Коксаки B3 во время репликации в сердце мышей и культурах сердечных миоцитов и коррелируют с инкапсуляцией вирусной РНК с отрицательной цепью. Журнал вирусологии. 2005;79(11): 7024–7041. doi: 10.1128/ОВИ.79.11.7024-7041.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Журнал вирусологии. 2005;79(11): 7024–7041. doi: 10.1128/ОВИ.79.11.7024-7041.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Lloyd RE. Трансляционный контроль вирусными протеиназами. Вирус рез. 2006;119(1):76–88. doi: 10.1016/j.virusres.2005.10.016. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Colli ML, Nogueira TC, Allagnat F, et al. Воздействие вирусного побочного продукта дцРНК или вируса Коксаки B5 запускает апоптоз бета-клеток поджелудочной железы посредством дисбаланса Bim/Mcl-1. PLoS Патог. 2011;7(9):e1002267. doi: 10.1371/journal.ppat.1002267. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Ifie E, Russell MA, Dhayal S, et al. Неожиданное субклеточное распределение специфической изоформы рецептора Коксаки и аденовируса, CAR-SIV, в бета-клетках поджелудочной железы человека. Диабетология. 2018;61(11):2344–2355. doi: 10.1007/s00125-018-4704-1. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Sioofy-Khojine AB, Lehtonen J, Nurminen N, et al. Инфекции, вызванные вирусом Коксаки B1, связаны с инициацией инсулинозависимого аутоиммунитета, который прогрессирует до диабета 1 типа. Диабетология. 2018;61(5):1193–1202. doi: 10.1007/s00125-018-4561-y. [PubMed] [CrossRef] [Google Scholar]
Sioofy-Khojine AB, Lehtonen J, Nurminen N, et al. Инфекции, вызванные вирусом Коксаки B1, связаны с инициацией инсулинозависимого аутоиммунитета, который прогрессирует до диабета 1 типа. Диабетология. 2018;61(5):1193–1202. doi: 10.1007/s00125-018-4561-y. [PubMed] [CrossRef] [Google Scholar]
37. Elmastour F, Jaidane H, Benkahla M, et al. Активность антикоксакивируса B4 (CV-B4), усиливающая активность сыворотки, связана с повышенной вирусной нагрузкой и патологией у мышей, реинфицированных CV-B4. Вирулентность. 2017;8(6):908–923. doi: 10.1080/21505594.2016.1252018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Kuss SK, Best GT, Etheredge CA, et al. Кишечная микробиота способствует репликации кишечных вирусов и системному патогенезу. Наука. 2011;334(6053):249–252. doi: 10.1126/science.1211057. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Afonso G, Mallone R. Инфекционные триггеры при диабете 1 типа: есть ли основания для мимикрии эпитопов? Сахарный диабет Ожирение Metab. 2013; 15 (Приложение 3): 82–88. doi: 10.1111/dom.12166. [PubMed] [CrossRef] [Google Scholar]
2013; 15 (Приложение 3): 82–88. doi: 10.1111/dom.12166. [PubMed] [CrossRef] [Google Scholar]
40. Эйзирик Д.Л., Миани М., Кардозо А.К. Сигнальная опасность: стресс эндоплазматического ретикулума и реакция развернутого белка при воспалении островков поджелудочной железы. Диабетология. 2013;56(2):234–241. doi: 10.1007/s00125-012-2762-3. [PubMed] [CrossRef] [Академия Google]
41. Марре М.Л., Джеймс Э.А., Пиганелли Д.Д. Стресс β-клеток ER и последствия для иммуногенности при диабете 1 типа. Front Cell Dev Biol. 2015;3:67. doi: 10.3389/fcell.2015.00067. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Phelps EA, Cianciaruso C, Michael IP, et al. Аберрантное накопление диабетического аутоантигена GAD65 в мембранах Гольджи в условиях стресса ЭР и аутоиммунитета. Диабет. 2016;65(9):2686–2699. doi: 10.2337/db16-0180. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Cianciaruso C, Phelps EA, Pasquier M, et al. Первичные β-клетки человека и крысы выделяют внутриклеточные аутоантигены GAD65, IA-2 и проинсулин в экзосомах вместе с цитокин-индуцированными усилителями иммунитета. Диабет. 2017;66(2):460–473. doi: 10.2337/db16-0671. [PubMed] [CrossRef] [Google Scholar]
Диабет. 2017;66(2):460–473. doi: 10.2337/db16-0671. [PubMed] [CrossRef] [Google Scholar]
44. Serreze DV, Ottendorfer EW, Ellis TM, Gauntt CJ, Atkinson MA. Ускорение развития диабета 1-го типа из-за коксакивирусной инфекции требует предсуществующей критической массы аутореактивных Т-клеток в панкреатических островках. Диабет. 2000;49(5): 708–711. doi: 10.2337/диабет.49.5.708. [PubMed] [CrossRef] [Google Scholar]
45. Kanno T., Kim K., Kono K., Drescher K.M., Chapman N.M., Tracy S. Диабетогенный фенотип вируса Коксаки группы B коррелирует с эффективностью репликации. Журнал вирусологии. 2006;80(11):5637–5643. doi: 10.1128/ОВИ.02361-05. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Larsson PG, Lakshmikanth T, Laitinen OH, et al. Доклиническое исследование эффективности и безопасности новой вакцины против вируса Коксаки B1 не выявило риска ускоренного развития диабета на моделях мышей. Диабетология. 2015;58(2):346–354. doi: 10.1007/s00125-014-3436-0. [PubMed] [CrossRef] [Академия Google]
[PubMed] [CrossRef] [Академия Google]
47. Horwitz MS, Ilic A, Fine C, Balasa B, Sarvetnick N. Диабет, опосредованный вирусом Коксаки: индукция требует наличия антиген-представляющих клеток и сопровождается фагоцитозом бета-клеток. Клин Иммунол. 2004;110(2):134–144. doi: 10.1016/j.clim.2003.09.014. [PubMed] [CrossRef] [Google Scholar]
48. Horwitz Marc S., Bradley Linda M., Harbertson Judith, Krahl Troy, Lee Jae, Sarvennick Nora. Диабет, вызванный вирусом Коксаки: инициация случайным повреждением, а не молекулярной мимикрией. Природная медицина. 1998;4(7):781–785. doi: 10.1038/nm0798-781. [PubMed] [CrossRef] [Google Scholar]
49. Pugliese A. Аутореактивные Т-клетки при диабете 1 типа. Джей Клин Инвест. 2017;127(8):2881–2891. doi: 10.1172/JCI94549. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Gallagher GR, Brehm MA, Finberg RW, et al. Вирусная инфекция привитых островков человека приводит к диабету. Диабет. 2015;64(4):1358–1369. doi: 10. 2337/db14-1020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2337/db14-1020. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Kundu R, Knight R, Dunga M, Peakman M. Подходы in silico и ex vivo указывают на иммунное давление на капсидные и некапсидные области вирусов Коксаки B в организме человека. ПЛОС Один. 2018;13(6):e0199323. doi: 10.1371/journal.pone.0199323. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Stone VM, Hankaniemi MM, Svedin E, et al. Вакцина против вируса Коксаки B защищает от диабета, вызванного вирусом, в экспериментальной мышиной модели диабета 1 типа. Диабетология. 2018;61(2):476–481. doi: 10.1007/s00125-017-4492-з. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Insel RA, Dunne JL, Atkinson MA, et al. Стадия предсимптомного диабета 1 типа: научное заявление JDRF, Эндокринного общества и Американской диабетической ассоциации. Уход за диабетом. 2015;38(10):1964–1974. дои: 10.2337/dc15-1419. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Alidjinou EK, Sane F, Bertin A, Caloone D, Hober D. Персистирующая инфекция клеток поджелудочной железы человека вирусом Коксаки B4 лечится флуоксетином. Антивир Рез. 2015;116:51–54. doi: 10.1016/j.antiviral.2015.01.010. [PubMed] [CrossRef] [Академия Google]
Alidjinou EK, Sane F, Bertin A, Caloone D, Hober D. Персистирующая инфекция клеток поджелудочной железы человека вирусом Коксаки B4 лечится флуоксетином. Антивир Рез. 2015;116:51–54. doi: 10.1016/j.antiviral.2015.01.010. [PubMed] [CrossRef] [Академия Google]
55. Окада М., Эномото М., Кавада Н., Нгуен М.Х. Эффекты противовирусной терапии у больных хроническим гепатитом В и циррозом печени. Эксперт Преподобный Гастроэнтерол Гепатол. 2017;11(12):1095–1104. doi: 10.1080/17474124.2017.1361822. [PubMed] [CrossRef] [Google Scholar]
56. Soriano V, Labarga P, Fernandez-Montero JV, et al. Лечение гепатита С противовирусной терапией – преимущества не только для печени. Антивир Тер. 2016;21(1):1–8. doi: 10.3851/IMP2975. [PubMed] [CrossRef] [Академия Google]
57. Badia-Boungou F, Sane F, Alidjinou EK, et al. Маркер инфекции вирусом Коксаки-В4 в слюне больных сахарным диабетом 1 типа. Diabetes Metab Res Rev. 2017;33:e2916. doi: 10.1002/dmrr.2916. [PubMed] [CrossRef] [Google Scholar]
58. Hammerstad SS, Tauriainen S, Hyoty H, Paulsen T, Norheim I, Dahl-Jorgensen K. Обнаружение энтеровируса в ткани щитовидной железы у пациентов с болезнью Грейвса. J Med Virol. 2013;85(3):512–518. doi: 10.1002/jmv.23476. [PubMed] [CrossRef] [Академия Google]
Hammerstad SS, Tauriainen S, Hyoty H, Paulsen T, Norheim I, Dahl-Jorgensen K. Обнаружение энтеровируса в ткани щитовидной железы у пациентов с болезнью Грейвса. J Med Virol. 2013;85(3):512–518. doi: 10.1002/jmv.23476. [PubMed] [CrossRef] [Академия Google]
59. Hammerstad SS, Jahnsen FL, Tauriainen S, Hyöty H, Paulsen T, Norheim I, Dahl-Jørgensen K. Воспаление и повышенная экспрессия белка A устойчивости к миксовирусам в ткани щитовидной железы на ранних стадиях тиреоидита Хашимото. Щитовидная железа. 2013;23(3):334–341. doi: 10.1089/thy.2012.0264. [PubMed] [CrossRef] [Google Scholar]
60. Nederstigt C, Uitbeijerse B, Janssen L, Corssmit EP, de Koning E, Dekkers O (2018) Ассоциированное аутоиммунное заболевание у пациентов с диабетом 1 типа: систематический обзор и метаанализ. Евр Дж Эндокринол: 137–146. 10.1530/EJE-18-0515 [PubMed]
61. Оикаринен М., Тауриайнен С., Оикаринен С. и соавт. Диабет 1 типа связан с энтеровирусной инфекцией слизистой оболочки кишечника. Диабет. 2012;61(3):687–691. doi: 10.2337/db11-1157. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Диабет. 2012;61(3):687–691. doi: 10.2337/db11-1157. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Proventionbio (2017) Provention Bio, Inc. Объявляет клиническую программу, направленную на выявление и предотвращение возникновения диабета 1 типа. Доступно на http://investors.proventionbio.com/2017-07-18-Provention-Bio-Inc-Announces-Clinical-Program-Focused-on-Intercepting-and-Preventing-the-Onset-of-Type-1- Диабет. По состоянию на 18 декабря 2018 г.
Инактивированная адъювантная вакцина против энтеровируса 71 безопасна и эффективна против смертельных энтеровирусных инфекций у детей в возрасте от 2 до 71 месяца.
2. Большинство нежелательных явлений были легкими и проходили самостоятельно, без госпитализаций или летальных исходов в группе EV71vac.
Уровень доказательности: 1 (отлично)
Краткое изложение исследования: Энтеровирус 71 (EV71) представляет собой одноцепочечную РНК, ответственную за заболевание рук, ящура и рта (HFMD) у детей. Хотя большинство инфекций EV71 являются доброкачественными, некоторые из них могут привести к серьезным последствиям. Профилактическое лечение EV71 включает вакцины; однако они воздействуют на определенный генотип и эффективны только у детей в возрасте 6–35 месяцев. Это рандомизированное контролируемое исследование было направлено на оценку безопасности, эффективности и иммуногенности вакцины EV71 (EV71vac) — инактивированной цельновирусной вакцины — у детей в возрасте от 2 до 71 месяца. Первичным исходом была общая эффективность EV71vac, оцененная через две недели после введения второй дозы, в то время как ключевыми вторичными исходами были госпитализации и смерти, связанные с EV71. Согласно результатам исследования, EV71vac показал высокую эффективность против заболеваний, связанных с энтеровирусом, с минимальными побочными эффектами. Все лабораторно подтвержденные случаи EB71-ассоциированного заболевания в этом исследовании произошли в группе плацебо. Хотя это исследование было хорошо проведено, в нем не учитывался социально-экономический статус участников, который является основным фактором, определяющим распространенность и тяжесть энтеровирусных инфекций.
Хотя большинство инфекций EV71 являются доброкачественными, некоторые из них могут привести к серьезным последствиям. Профилактическое лечение EV71 включает вакцины; однако они воздействуют на определенный генотип и эффективны только у детей в возрасте 6–35 месяцев. Это рандомизированное контролируемое исследование было направлено на оценку безопасности, эффективности и иммуногенности вакцины EV71 (EV71vac) — инактивированной цельновирусной вакцины — у детей в возрасте от 2 до 71 месяца. Первичным исходом была общая эффективность EV71vac, оцененная через две недели после введения второй дозы, в то время как ключевыми вторичными исходами были госпитализации и смерти, связанные с EV71. Согласно результатам исследования, EV71vac показал высокую эффективность против заболеваний, связанных с энтеровирусом, с минимальными побочными эффектами. Все лабораторно подтвержденные случаи EB71-ассоциированного заболевания в этом исследовании произошли в группе плацебо. Хотя это исследование было хорошо проведено, в нем не учитывался социально-экономический статус участников, который является основным фактором, определяющим распространенность и тяжесть энтеровирусных инфекций.
Нажмите, чтобы прочитать исследование в журнале The Lancet
Соответствующие материалы: вакцина против инактивированного энтеровируса 71 у здоровых детей
Углубленное [рандомизированное контролируемое исследование]: В период с 23 апреля по 25 декабря 2019 г. было обследовано 3664 пациента для соответствия требованиям в нескольких больницах Тайваня и Вьетнама. Детям случайным образом назначали две дозы EV71vac или плацебо (1:1) с 56-дневным перерывом между обеими дозами. Всего в анализ эффективности было включено 2959 пациентов (1483 в группе плацебо и 1476 в группе EV71vac). В группе EV71vac скорректированная эффективность вакцины составила 96,8% (95% доверительный интервал [ДИ] 85,5–100,0, р<0,0001). Уровень заболеваемости на 1000 человеко-лет был значительно выше в группе плацебо (11,15, 95% ДИ 7,34–16,94), чем у EV71vac (0,00, 95% ДИ 0,00, p<0,0001). Вторичный результат осложнений, связанных с EV71, был немного выше в группе плацебо (4 госпитализации и 0 смертей), чем у EV71vac (0 госпитализаций и смертей).
