Содержание
Превенар інструкція, ціна в аптеках України
Дозування
- Пневмококовий олігосахарид серотипу 18С: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 1: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 14: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 19A: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 19F: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 23F: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 3: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 4: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 5: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 6А: 2.2 мг/доза (2)
- Пневмококовий полісахарид серотипу 6В: 4.4 мг/доза (2)
- Пневмококовий полісахарид серотипу 7F: 2.2 мг/доза (2)
Згорнути
Ще
Кому можна
- Дорослим (2)
- Дітям (2)
- Алергікам (2)
- Діабетикам (2)
- Водіям (1)
- Список товарів
Ціни в аптеках
Товарів: 2
Сортування:
За рейтингомВід дешевихВід дорогих
Перейти до кошика
Перейти до кошика
Разом дешевше
Редакторська група
Дата створення: 27. 04.2021
04.2021
Дата оновлення: 08.11.2022
Склад і форма випуску
Склад
діючі речовини: одна доза (0, 5 мл) містить:
- пневмококової полісахарид серотип 4 * 2 мкг,
- пневмококової полісахарид серотип 6В * 4 мкг,
- пневмококової полісахарид серотип 9V * 2 мкг,
- пневмококової полісахарид серотип 14 * 2 мкг,
- пневмококової олігосахарид серотип 18С * 2 мкг,
- пневмококової полісахарид серотип 19F * 2 мкг,
- пневмококової полісахарид серотип 23F * 2 мкг
CRM 197 білок-носій ~ 20 мкг
Допоміжні речовини: алюмінію фосфат, натрію хлорид, вода для ін’єкцій.
Форма випуску
Суспензія для ін’єкцій у попередньо наповненому шприці (по 0,5 мл суспензії для ін’єкцій в попередньо наповненому шприці з однієї відокремленої голкою вкладають в закритий пластиковий контейнер. Пластиковий контейнер разом з інструкцією із застосування поміщають в картонну коробку).
Основні фізико-хімічні властивості
Вакцина у вигляді білої гомогенної суспензії.
Імунологічні та біологічні властивості
імуногенність
Значне збільшення кількості антитіл (за методом ELISA) до всіх серотипів вакцини спостерігалося після первинної вакцинації немовлят трьома дозами з наступною ревакцинацією, хоча середньогеометричні концентрації варіювали між 7 серотіпамі. Також було продемонстровано, що Превенар активує функціональні антитіла (за методом опсонофагоцітозу) до всіх серотипів вакцини після первинної вакцинації. Довготривала персистенция антитіл після первинної вакцинації з ревакцинацією в немовлят або після одноразової первинної імунізації у дітей більш старшого віку не вивчалася. Застосування некон’югованого пневмококових полісахаридів через 13 місяців після первинної вакцинації Превенар активовано вторинна імунна відповідь 7 серотипів, що входять в вакцину, вказує на те, що первинна імунізація відбулася.
Імуногенність первинної дводозовоі вакцинації немовлят з ревакцинацією у віці приблизно одного року було підтверджено в кількох дослідженнях. При прямому або побічно порівнянні більшість даних вказують на те, що після первинної дводозовоі вакцинації кількість дітей, у яких концентрація антитіл проти серотипів 6В і 23F досягла ≥0,35 мкг/мл (концентрація антитіл, рекомендована ВООЗ) [1], була менше, ніж при первинній вакцинації з трьох доз. Крім того, середньогеометричні концентрації антитіл до більшості серотипів були нижче після дводозовоі вакцинації немовлят, ніж після вакцинації немовлят з трьох доз. Однак інтенсивність утворення антитіл у відповідь на ревакцинацію у дітей раннього віку була порівнянною для всіх 7 серотипів вакцини як після вакцинації немовлят двома дозами, так і після вакцинації трьома дозами, що вказувало на те, що обидва режими застосування у немовлят викликали адекватну первинну імунізацію.
При прямому або побічно порівнянні більшість даних вказують на те, що після первинної дводозовоі вакцинації кількість дітей, у яких концентрація антитіл проти серотипів 6В і 23F досягла ≥0,35 мкг/мл (концентрація антитіл, рекомендована ВООЗ) [1], була менше, ніж при первинній вакцинації з трьох доз. Крім того, середньогеометричні концентрації антитіл до більшості серотипів були нижче після дводозовоі вакцинації немовлят, ніж після вакцинації немовлят з трьох доз. Однак інтенсивність утворення антитіл у відповідь на ревакцинацію у дітей раннього віку була порівнянною для всіх 7 серотипів вакцини як після вакцинації немовлят двома дозами, так і після вакцинації трьома дозами, що вказувало на те, що обидва режими застосування у немовлят викликали адекватну первинну імунізацію.
Значне збільшення кількості антитіл (за методом ELISA) до всіх серотипів вакцини спостерігалося після введення одноразової дози Превенар дітям у віці від 2 до 5 років. Концентрації антитіл були подібними до тих, що досягалися після вакцинації немовлят, що складалася з трьох доз, і ревакцинації у віці до 2 років. Дослідження по клінічної ефективності в популяції у віці від 2 до 5 років не проводилися.
Дослідження по клінічної ефективності в популяції у віці від 2 до 5 років не проводилися.
Клінічних досліджень по ефективності первинної дводозовоі вакцинації немовлят з ревакцинацією не проводилося, тому немає даних клінічного значення нижчих концентрацій антитіл проти серотипів 6В і 23F після дводозовоі вакцинації немовлят.
Ефективність проти інвазивного захворювання
Оцінки ефективності проти інвазивного захворювання були отримані в популяції США, де поширеність серотипів вакцини становила від 80% до 89%. Епідеміологічні дані по 1988 — 2003 pp. вказують на те, що в Європі поширеність менше і варіює між різними країнами. Отже, в європейських дітей Превенар повинен захищати від інвазивного пневмококової захворювання у 54% — 84% випадків у дітей до 2 років і у 62% — 83% випадків у віковій групі від 2 до 5 років. За оцінками, більше 80% штамів, резистентних до антимікробних засобів, будуть охоплюватися серотіпамі, що входять до цієї вакцини. Поширеність серотипів вакцини в педіатричній популяції знижується зі збільшенням віку. Зниження частоти інвазивного пневмококової захворювання, спостерігається у дітей більш старшого віку, може бути частково зумовленим природно набутим імунітетом.
Зниження частоти інвазивного пневмококової захворювання, спостерігається у дітей більш старшого віку, може бути частково зумовленим природно набутим імунітетом.
Ефективність проти інвазивного захворювання оцінювалася в великомасштабному рандомізованому, подвійному-сліпому клінічному дослідженні багатоетнічної популяції в Північній Каліфорнії (дослідження Keiser Permanente). Більше 37 816 немовлят були імунізовані Превенар або контрольної вакциною (менінгококова кон’югована вакцина, група С) у віці 2, 4, 6 і 12-15 місяців. На час проведення дослідження серотипу, що входять в вакцини, були причиною 89% інвазивного пневмококової захворювання.
Загалом 52 випадки інвазивного захворювання, викликаного серотіпамі вакцини, спостерігалося в сліпому контрольному періоді на 20 квітня 1999 Оцінка специфічної активності серотипів вакцини становила 94% (ДІ 2 95%: 88, 99) в популяції пацієнтів, які були включені в дослідження ( «intent -to-treat ») і 97% (95% ДІ: 85, 100) в популяції згідно з протоколом (повністю імунізованих) (40 випадків). В Європі оцінки ефективності у дітей молодше 2 років становили 51% — 79% з урахуванням захисту вакцини проти серотипів, що викликають инвазивное захворювання.
В Європі оцінки ефективності у дітей молодше 2 років становили 51% — 79% з урахуванням захисту вакцини проти серотипів, що викликають инвазивное захворювання.
Ефективність проти пневмонії
У дослідженні Keiser Permanente ефективність проти бактеріальної пневмонії, викликаної серотіпамі вакцини S. pneumoniae, склала 87,5% (95% ДІ: 7, 99). Також оцінювалася ефективність проти цього не бактеріальної пневмонії (мікробіологічне підтвердження діагнозу не проводилося). Оскільки важкий перебіг пневмонії у дітей можуть обумовлювати багато інших патогенів, крім пневмококових серотипів, представлених у вакцині, очікується, що захист від усіх клінічних пневмоній буде нижче, ніж від інвазивного пневмококової захворювання. В аналізі, проведеному згідно з протоколом, очікуване зниження ризику першого епізоду клінічної пневмонії з нетиповими результатами рентгенографії грудної клітини (визначені як наявність інфільтратів за perihilar ділянкою, ущільнення або емпієма) склало 20,5% (95% ДІ: 4,4, 34, 0 ). Показники зниження випадків пневмонії з нетиповими результатами рентгенографії грудної клітини були найбільшими в перший рік життя — 32% (95% ДІ: 3,3, 52,5) і в перші 2 роки життя — 23,4% (95% ДІ: 5, 2, 38,1).
Показники зниження випадків пневмонії з нетиповими результатами рентгенографії грудної клітини були найбільшими в перший рік життя — 32% (95% ДІ: 3,3, 52,5) і в перші 2 роки життя — 23,4% (95% ДІ: 5, 2, 38,1).
Ефективність проти середнього отиту Гострий середній отит є поширеним дитячим захворюванням, має різну етіологію. Бактерії можуть викликати 60-70% клінічних випадків гострого середнього отиту. Пневмококки викликають 30-40% від загальної кількості випадків бактеріального гострого середнього отиту і більшість важких гострих середніх отитів. Теоретично Превенар може попереджати приблизно 60-80% випадків пневмококової гострого середнього отиту, викликаних серотіпамі вакцини. За оцінками, Превенар може попереджати 6-13% всіх клінічних випадків гострого середнього отиту.
Ефективність Превенар проти гострого середнього отиту оцінювалася в рандомізованому, подвійному-сліпому клінічному дослідженні за участю тисячу шістсот шістьдесят-два фінських немовлят, імунізованих Превенар або контрольної вакциною (вакцина проти гепатиту В) в віці 2, 4, 6 і 12-15 місяців. Ефективність вакцини проти гострого середнього отиту, викликаного вакцинним серотипом (первинна кінцева точка дослідження) склала 57% (95% ДІ: 44, 67) при аналізі згідно з протоколом і 54% (95% ДІ: 41, 64) в аналізі всіх пацієнтів, які були включені в дослідження. У імунізованих суб’єктів спостерігалося підвищення частоти виникнення гострих середніх отитів на 33% (95% ДІ: 1, 80) через серогрупи, не включені в вакцину. Однак загальна користь склала 34% (95% ДІ: 21, 45) зниження частоти всіх пневмококових гострих середніх отитів. При застосуванні вакцини загальна кількість епізодів середнього отиту незалежно від етіології знизилася на 6% (95% ДІ: 4, 16).
Ефективність вакцини проти гострого середнього отиту, викликаного вакцинним серотипом (первинна кінцева точка дослідження) склала 57% (95% ДІ: 44, 67) при аналізі згідно з протоколом і 54% (95% ДІ: 41, 64) в аналізі всіх пацієнтів, які були включені в дослідження. У імунізованих суб’єктів спостерігалося підвищення частоти виникнення гострих середніх отитів на 33% (95% ДІ: 1, 80) через серогрупи, не включені в вакцину. Однак загальна користь склала 34% (95% ДІ: 21, 45) зниження частоти всіх пневмококових гострих середніх отитів. При застосуванні вакцини загальна кількість епізодів середнього отиту незалежно від етіології знизилася на 6% (95% ДІ: 4, 16).
У цьому дослідженні підгрупа дітей перебувала під наглядом до досягнення віку 4-5 років. За даними спостереження ефективність вакцини проти частого середнього отиту (певного як мінімум 3 епізоду протягом 6 місяців) склала 18% (95% ДІ: 1, 32), проти хронічного середнього отиту з випотом 50% (95% ДІ: 15, 71) і проти потреби у встановленні тімпаностомічноі трубки — 39% (95% ДІ: 4, 61).
Ефективність Превенар проти гострого середнього отиту оцінювалася як вторинна кінцева точка в дослідженні Keiser Permanente. Діти перебували під наглядом до 3,5 років. При застосуванні вакцини загальна кількість епізодів середнього отиту незалежно від етіології знизилася на 7% (95% ДІ: 4, 10). При аналізі згідно з протоколом вплив вакцини на зменшення кількості випадків рецидивуючого гострого середнього отиту склав 9% (95% ДІ: 3, 15), коли рецидивуючий гострий середній отит визначався як 3 епізоду протягом 6 місяців або 4 епізоду в рік, але якщо рецидивний гострий середній отит визначався як 5 епізодів протягом 6 місяців або 6 епізодів на рік, зменшення кількості випадків склало 23% (95% ДІ: 7, 36). Потреба у встановленні тімпаностомічноі трубки (трубки для вентиляції середнього вуха) знизилася на 24% (95% ДІ: 12, 35) при аналізі згідно з протоколом і на 23% (95% ДІ: 11, 34) при аналізі всіх пацієнтів, які були включені в дослідження.
Ефективність
Ефективність Превенар проти інвазивного пневмококової захворювання (тобто, включаючи захист, забезпечує вакцинація, і захист, отриманий від популяційного імунітету через знижену передачу серотипів вакцини в популяції) оцінювалася в національних програмах імунізації, в яких застосовувалася дводозова або трідозова вакцинація новонароджених з ревакцинацією.
У США загальна вакцинація Превенар із застосуванням курсу з чотирьох доз немовлятам і «турової» вакцинації ( «catch-up») дітям у віці до 5 років була введена в 2000 р. Ефективність вакцини проти інвазивного пневмококової захворювання, викликаного серотіпамі вакцини, оцінювалася у віці від 3 до 59 місяців протягом перших чотирьох років від введення цієї програми. При порівнянні з відсутністю вакцинації точкові оцінки ефективності 2, 3 і 4 доз, які вводили за схемою, призначеної для немовлят, були однаковими: 96% (95% ДІ: 88-99) 95% (95% ДІ: 88-99) і 100% (95% ДІ: 94-100), відповідно. У США в той же період часу спостерігалося зменшення на 94% частоти інвазивного пневмококової захворювання вакцинного типу у осіб молодше 5 років у порівнянні з вихідними даними до проведення вакцинації (1998/99). Паралельно спостерігалося зменшення на 62% частоти інвазивного пневмококової захворювання вакцинного типу у осіб старше 5 років. Цей непрямий або популяційний ефект обумовлений зменшенням передачі вакцинних серотипів від імунізованих маленьких дітей до інших представників популяції і збігається зі зниженням носійства серотипів вакцини в носоглотці.
У провінції Квебек, Канада, Превенар застосовували у віці 2, 4 і 12 місяців одночасно з «Турів» вакцинацією ( «catch-up») однієї дозою дітей у віці до 5 років. У перші два роки програми з покриттям більше 90% ефективність проти інвазивного пневмококової захворювання, викликаного серотіпамі вакцини, склала 93% (95% ДІ: 75-98) для дводозовоі вакцинації немовлят і 100% (95% ДІ: 91-100) для повністю виконаної схеми.
Попередні дані по Англії і Уельсу, які були отримані менш ніж через 1 рік після введення планової імунізації в 2, 4 і 13 місяців одночасно з «Турів» вакцинацією ( «catch-up») однієї дозою дітей від 13 до 23 місяців, свідчать про тому, що ефективність цієї схеми може бути нижче проти серотипу 6В, ніж проти інших серотипів цієї вакцини.
Ефективність первинної дводозовоі вакцинації проти пневмонії або гострого середнього отиту не встановлено.
Додаткові дані по імуногенності
Імуногенність Превенар досліджували у відкритому багато центровий дослідженні проведеному за участю 49 немовлят з серповидно-клітинною захворюванням. Діти були вакциновані Превенар (3 дози з інтервалом в один місяць починаючи з віку 2 місяці), 46 з цих дітей також отримували 23-валентну пневмококової полисахаридную вакцину у віці 15- 18 місяців. Після первинної імунізації 95,6% суб’єктів мали рівні антитіл, які дорівнювали як мінімум 0,35 мкг/мл для всіх семи серотипів Превенар. Після вакцинації полисахаридной вакциною спостерігалося значне підвищення концентрацій антитіл проти семи серотипів, що свідчить про хорошу імунологічну пам’ять.
Діти були вакциновані Превенар (3 дози з інтервалом в один місяць починаючи з віку 2 місяці), 46 з цих дітей також отримували 23-валентну пневмококової полисахаридную вакцину у віці 15- 18 місяців. Після первинної імунізації 95,6% суб’єктів мали рівні антитіл, які дорівнювали як мінімум 0,35 мкг/мл для всіх семи серотипів Превенар. Після вакцинації полисахаридной вакциною спостерігалося значне підвищення концентрацій антитіл проти семи серотипів, що свідчить про хорошу імунологічну пам’ять.
Показання до застосування
Активна імунізація проти захворювань, викликаних Streptococcus pneumoniae серотипів 4, 6В, 9V, 14, 18С, 19F і 23F (включаючи сепсис, менінгіт, пневмонію, бактеріємії і гострий середній отит ) у немовлят і дітей віком від 2 місяців до 5 років.
Протипоказання
Підвищена чутливість до діючих речовин або до будь-якого з допоміжних речовин, або до дифтерійного анатоксину.
Застосування
Превенар повинен визначатися на основі офіційних рекомендацій з урахуванням впливу інвазивних захворювань в різних вікових групах, а також варіабельності епідеміології серотипів в різних географічних зонах.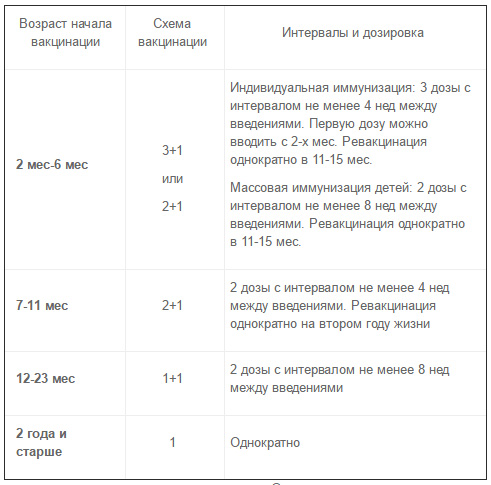
Спосіб застосування та дози
Вакцину слід вводити внутрішньом’язово. Препарат бажано вводити в наступні ділянки: передньолатеральну поверхню стегна (латеральний широкий м’яз стегна) у немовлят або дельтоподібний м’яз плеча у маленьких дітей.
Схема імунізації
Схема імунізації Превенар повинна базуватися на офіційних рекомендаціях.
Немовлята у віці від 2 до 6 місяців:
Первинна вакцинація у немовлят складається з трьох доз, по 0,5 мл кожна, першу дозу, як правило, вводять у віці 2 місяці. Інтервал між дозами становить не менше 1 місяця. Четверту дозу (ревакцинація) рекомендується вводити на другому році життя.
В якості альтернативи, коли Превенар вводиться як складова стандартної імунізації немовлят, можна розглядати схему з введенням двох доз. Першу дозу можна вводити, починаючи з 2-місячного віку, другу — як мінімум через 2 місяці, а третю (для ревакцинації) дозу — у віці від 11 до 15 місяців.
Немовлята більш старшого віку і діти, які не проходили вакцинацію:
Немовлята у віці від 7 до 11 місяців: дві дози, по 0,5 мл кожна, з інтервалом між дозами не менше 1 місяця. Третю дозу рекомендується вводити на другому році життя.
Третю дозу рекомендується вводити на другому році життя.
Діти у віці від 12 до 23 місяці: дві дози, по 0,5 мл кожна, з інтервалом між дозами не менше 2 місяців.
Діти у віці від 24 місяців до 5 років одна доза.
Потреба в дозі для ревакцинації після таких схем імунізації не встановлено.
Передозування
Є повідомлення про передозування Превенар, включаючи випадки застосування більшого, ніж рекомендована, дози та випадки застосування наступних доз через менший, ніж рекомендовано, інтервал часу після попередньої дози. У більшості осіб не повідомлялося про небажані ефекти. Загалом, небажані явища, про які повідомлялося при передозуванні, були такими ж, як і при застосуванні рекомендованих одноразових доз Превенар.
Побічні дії
Безпечність вакцини оцінювали в різних контрольованих клінічних дослідженнях, в які були включені більш ніж 18 000 здорових немовлят (у віці від 6 тижнів до 18 місяців). Більшість результатів з безпеки отримано в дослідженні ефективності, в якому 17066 немовлят отримали 55 352 дози Превенар. Також оцінювалася безпека у дітей більш старшого віку, яким раніше вакцинація не проводилася.
Також оцінювалася безпека у дітей більш старшого віку, яким раніше вакцинація не проводилася.
У всіх дослідженнях Превенар застосовували одночасно з вакцинами, які рекомендовані для застосування у дітей.
До небажаних реакцій, про які повідомлялося найчастіше, відносяться реакції в місці введення і лихоманка.
При проведенні первинної вакцинації та ревакцинації підвищення частоти місцевих або загальних реакцій не спостерігалося, за винятком більш частого виникнення тимчасової хворобливості (36,5%) і хворобливості, що обмежує руху кінцівки (18,5%), які спостерігалися при ревакцинації.
У дітей старше 2 років, яким проводилася вакцинація однієї дозою, місцеві реакції спостерігалися частіше, ніж у немовлят. Ці реакції мали переважно тимчасовий характер. У постмаркетинговомуу дослідженні за участю 115 дітей у віці від 2 до 5 років виникнення хворобливості спостерігалося в 39,1% дітей; хворобливості, що обмежує руху кінцівки — в 15,7% дітей. Гіперемія в місці введення виникала у 40,0% дітей, інфільтрат — в 32,2%; гіперемія або інфільтрат, розмір яких був більш 2 см в діаметрі, спостерігалися в 22,6% і 13,9% дітей відповідно.
При одночасному застосуванні Превенар з шестивалентний вакцинами (DТаР / Ніb (РrР-Т) / ІРV / нерва) підвищення температури тіла ≥ 38 °C спостерігалась у 28,3% — 48,3% немовлят в групі, яка одночасно отримувала Превенар і шестивалентний вакцину в порівнянні з 15,6% — 23,4% в групі, що одержувала тільки шестивалентний вакцину. Підвищення температури тіла вище 39,5 °C спостерігалась у 0,6% — 2,8% немовлят, які отримували Превенар і шестивалентного вакцини.
Реактогенність була більше у дітей, які одночасно отримували цільноклітинні кашлюкових вакцини. У дослідженні за участю 1662 дітей підвищення температури тіла ≥38 °C спостерігалась у 41,2% дітей, які отримували Превенар одночасно з комбінованою вакциною проти дифтерії, коклюшу, правця, в порівнянні з 27,9% в контрольній групі. Підвищення температури тіла вище 39 °C спостерігалась у 3,3% дітей у порівнянні з 1,2% в контрольній групі.
Побічні ефекти, про які повідомлялося в клінічних дослідженнях або пост-маркетингового спостереження, наведені нижче за системами органів і частотою і відносяться до всіх вікових групах. Частота визначається наступним чином: дуже часто: ≥ 1/10, часто: ≥ 1/100 та
Частота визначається наступним чином: дуже часто: ≥ 1/10, часто: ≥ 1/100 та
З боку системи крові та лімфатичної системи:
Дуже рідкісні: лімфаденопатія, обмежена ділянкою ведення ін’єкції.
З боку імунної системи:
Рідкісні: реакції гіперчутливості, такі як анафілактичні / анафілактоїдні реакції, включаючи шок, ангіоневротичний набряк, бронхоспазм, задишка, набряк обличчя.
З боку нервової системи:
Рідкісні: судоми, включаючи судоми, що супроводжуються лихоманкою.
Шлунково-кишкові розлади:
Дуже часто: блювота, діарея, зниження апетиту.
З боку шкіри та підшкірної тканини:
Нечасто: висип / кропив’янка
Дуже рідкісні: багатоформна еритема
Загальні розлади та стани на ділянці введення:
Дуже часто: реакції в місці введення (еритема, інфільтрат / набряк, біль / болючість при торканні або натисненні) підвищення температури тіла ≥ 38 °C, дратівливість, плач, сонливість, неспокійний сон.
Часто: реакції в місці введення (набряк / інфільтрат з еритемою> 2,4 см), хворобливість, що обмежує руху кінцівки, підвищення температури тіла вище 39 °C.
Рідкісні: гіпотонічно гіпореактивний епізод, реакції гіперчутливості в місці введення (наприклад, дерматит, свербіж, висипи).
Апное у глибоко недоношених дітей (≤ 28 тижнів вагітності).
Особливі вказівки
Застосування в період вагітності та годування груддю
Превенар не призначений для застосування у дорослих. Інформація про безпеку вакцини при її застосуванні під час вагітності та годування груддю відсутній.
Діти
Чи не показаний для застосування у дітей віком до 2 місяців.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Превенар не призначений для застосування у дорослих.
Взаємодія з іншими лікарськими засобами та інші форми взаємодії
Превенар можна застосовувати одночасно з іншими педиатрическими вакцинами згідно з рекомендованими схемами імунізації. Різні ін’єкційні вакцини слід завжди вводити в різні ділянки тіла.
Імунну реакцію на планові педіатричні вакцини, що застосовувалися одночасно з Превенар (з введенням в різні ділянки тіла), оцінювали в 7 контрольованих клінічних дослідженнях. Антитілогенез у відповідь на ХІБ-вакцини, кон’югованих з правцева білком (PRP-T), а також на вакцини для профілактики правця і гепатиту В (нервові) був схожим з контрольними групами. Для ХІБ вакцини, кон’югованої з дифтерійним білком CRM, спостерігалося посилення утворенням антитіл до ХІБ (Haemophilus influenzae типу b) і дифтерії при імунізації немовлят. При ревакцинації спостерігалося деяке зниження рівня ХІБ-антитіл, однак у всіх дітей зберігалися захисні рівні. Спостерігалося тимчасове зниження імунної відповіді на антигени коклюшу, а також на інактивовану вакцину проти поліомієліту (IPV). Клінічна значущість цих взаємодій невідома. Обмежені дані відкритих досліджень показали прийнятну імунологічний відповідь при одночасному застосуванні з MMR-вакциною (проти кору, паротиту та краснухи) і вакциною проти вітряної віспи.
Антитілогенез у відповідь на ХІБ-вакцини, кон’югованих з правцева білком (PRP-T), а також на вакцини для профілактики правця і гепатиту В (нервові) був схожим з контрольними групами. Для ХІБ вакцини, кон’югованої з дифтерійним білком CRM, спостерігалося посилення утворенням антитіл до ХІБ (Haemophilus influenzae типу b) і дифтерії при імунізації немовлят. При ревакцинації спостерігалося деяке зниження рівня ХІБ-антитіл, однак у всіх дітей зберігалися захисні рівні. Спостерігалося тимчасове зниження імунної відповіді на антигени коклюшу, а також на інактивовану вакцину проти поліомієліту (IPV). Клінічна значущість цих взаємодій невідома. Обмежені дані відкритих досліджень показали прийнятну імунологічний відповідь при одночасному застосуванні з MMR-вакциною (проти кору, паротиту та краснухи) і вакциною проти вітряної віспи.
Дані щодо одночасного застосування Превенар з Інфанрікс Гекса (вакцина DTaP / Hib (PRP-T) / IPV / HepB) показали відсутність клінічно значущого впливу на утворенням антитіл до кожного окремого антигену при первинній вакцинації, яка складалася з 3 доз.
Нині немає достатніх даних взаємодії при одночасному застосуванні Превенар з іншими шестивалентний вакцинами.
У клінічному дослідженні, в якому порівнювали окреме і одночасне застосування Превенар (3 дози — в 2, 3.5 і 6 місяців і доза ревакцинації приблизно в 12 місяців) і Менінгітек (кон’юговані менінгококова вакцина С, дві дози — в 2 і 6 місяців і доза ревакцинації приблизно в 12 місяців), не спостерігалося ознак імунної взаємодії між двома кон’югованими вакцинами після первинної вакцинації або після ревакцинації.
Особливі вимоги до утилізації
При зберіганні може спостерігатися білий осад і прозора надосадову рідину. Перед застосуванням вакцину слід добре струсити для отримання однорідної білої суспензії та візуально перевірити на наявність сторонніх часток і / або зміни зовнішнього вигляду. Не застосовувати, якщо зміст виглядає інакше, ніж описано. Невикористані залишки або відходи слід утилізувати відповідно до місцевих вимог.
Умови зберігання.
Зберігати при температурі від 2 до 8 °C.
Чи не заморожувати!
Термін придатності — 4 роки
ПРЕВЕНАР® 13/PREVENAR® 13 ВАКЦИНА ПНЕВМОКОКОВА ПОЛІСАХАРИДНА КОН’ЮГОВАНА (ТРИНАДЦЯТИВАЛЕНТНА АДСОРБОВАНА)
(UA/15864/01/01)
Форма випуску:
суспензія для ін’єкцій по 1 дозі (0,5 мл) у попередньо наповненому шприці; по 1 попередньо наповненому шприцу та одній відокремленій голці в індивідуальному чохлі у закритому пластиковому контейнер; по 1 пластиковому контейнері у картонній коробці
Склад:
пневмококові полісахариди серотипів 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 19A, 19F і 23F, олігосахарид серотипу 18C, білок-носій CRM197 одна доза (0,5 мл) містить: пневмококового полісахариду серотипу 1* 2,2 мкг; пневмококового полісахариду серотипу 3* 2,2 мкг/пневмококового полісахариду серотипу 4* 2,2 мкг; пневмококового полісахариду серотипу 5* 2,2 мкг; пневмококового полісахариду серотипу 6A* 2,2 мкг; пневмококового полісахариду серотипу 6B* 4,4 мкг; пневмококового полісахариду серотипу 7F* 2,2 мкг; пневмококового полісахариду серотипу 9V* 2,2 мкг; пневмококового полісахариду серотипу 14* 2,2 мкг; пневмококового олігосахариду серотипу 18C* 2,2 мкг; пневмококового полісахариду серотипу 19A* 2,2 мкг; пневмококового полісахариду серотипу 19F* 2,2 мкг; пневмококового полісахариду серотипу 23F* 2,2 мкг; CRM197 білка-носія ~ 32 мкг/*Кон’югований з білком-носієм CRM197 та адсорбований на алюмінію фосфаті (0,125 мг алюмінію)
Производитель:
Бельгія
Превенар ціна в Аптеці 911
| Назва | Ціна |
|---|---|
Превенар 13 вакцина пневмокок. сусп. д/ін. 1доза шприц 0,5мл №1 сусп. д/ін. 1доза шприц 0,5мл №1 | 2330.04 грн. |
| Превенар 13 вакцина пневмокок. сусп. д/ін. 1доза шприц 0,5мл №1*** | 2993.26 грн. |
Ліки Контроль – Допомагаємо пацієнтам безоплатно отримати якісні, ефективні ліки та медичні послуги
Зазвичай, ми купуємо ліки перебуваючи у стані стресу.
Ми переживаємо за власне здоров’я, тривожимось станом здоров’я своїх рідних та близьких, тому нами часто можна маніпулювати.
Повідомлення щодо умов зберігання препаратів формуються з офіційних інструкцій до медичного застосування препаратів.
Часто ми стикаємось з неможливістю придбати ліки
через їх вартість,
відсутність необхідних ліків в аптеці,
а лікуватись треба вже сьогодні.
Саме тому ми розробили дуже ефективний і простий у використанні сервіс, щоб людина могла за кілька секунд перевірити ліки, убезпечивши себе від грубих підробок лікарських засобів.
Завантажуйте БЕЗКОШТОВНО
Перегляньте ролик – навчіться перевіряти ліки та знаходити аналоги до ліків
за 2 хвилини:
«Доступні ліки» в сервісах Ліки Контроль
Ліки, вартість яких повністю або частково оплачує держава за програмою «Доступні ліки» позначені в переліку лікарських засобів логотипом програми.
Як отримати безоплатні ліки? – Покрокова інструкція
Telegram та Viber чат-бот «Спитай Гриця» – простий шлях отримувати Доступні ліки пацієнтам з хронічними захворюваннями. Як?- «Спитай Гриця».
Гриць розповість:
- Де отримати ліки кожному пацієнту у селі, містечку чи мегаполісі
- Які препарати можна отримати в «Доступних ліках»
- Нагадає, що вже час отримувати наступний рецепт і нові «Доступні ліки»
- Допоможе організувати сімейну домашню аптечку і пам’ятатиме всі терміни придатності ваших ліків.

Ліки Контроль дозволяє
перевірити наявність ліків у Національному переліку лікарських засобів,
що мають бути безкоштовними для кожного пацієнта лікарні.
Нацперелік відкриває рівний і справедливий доступ пацієнтів до базового ефективного лікування хвороб, які є пріоритетними для України.
Telegram та Viber чат-бот «Лікуйся» – покроковий гід для пацієнток з раком молочної залози. Зорієнтує в можливостях безоплатних діагностики та лікування раку молочної залози в кожному регіоні України. Допоможе лікуватись дійсно безоплатно.
Чат-бот «Лікуйся» допомагає кожній пацієнтці, яка стикнулася з діагнозом «рак молочної залози», зорієнтуватися, в якому медичному закладі, які медичні послуги і в якому обсязі можна отримати безоплатно. Це стосується як послуг з діагностики онкологічних захворювань, так і їх лікування. Користувачка чат-боту зможе вибрати медичну послугу, отримати покрокову інструкцію для її отримання та обрати лікарню.
Це стосується як послуг з діагностики онкологічних захворювань, так і їх лікування. Користувачка чат-боту зможе вибрати медичну послугу, отримати покрокову інструкцію для її отримання та обрати лікарню.
Щоб довести, що лікування раку доступне не тільки для багатих і знаменитих, а й для звичайних людей з середнім і низьким рівнем достатку ми створили проєкт «Стань зіркою свого життя – Лікуйся безоплатно».
Сервіс Ліки для онкохворих- Підпишись на життя допоможе пацієнту знайти ліки,які можна отримати повністю безоплатно. Ми налаштували пошуковий алгоритм таким чином, щоб він максимально допоміг кожному пацієнту знайти можливість лікуватися безоплатно. Повідомить про надходження потрібного вам препарату у вибраний регіон.
На сайті ви знайдете всі ліки, які закуповує держава за напрямом онкологічні та онкогематологічні захворювання, а також ліки з Національного переліку основних лікарських засобів.
Сервіс Ліки Контроль базується на державних даних, розроблено ГО «ЛІКИ КОНТРОЛЬ».
Ми відслідковуємо нормативні документи та оновлюємо базу даних щодня.
В Ліки Контроль наведено інформацію про 100% ліків – це зручний сервіс без нав’язливої реклами. Щоб працювати далі, нам потрібна ваша допомога.
Читайте також: Як користуватись Ліки Контроль на повну?
Административная пневмококковая вакцина: для поставщиков
- Визуальное осмотр
- Маршрут, площадку и размер иглы
- и время доз
- Предварительные вакцины дозы
- . для введения пневмококковых вакцин, включая способ введения, количество доз и совместное введение с другими вакцинами.
Визуальный осмотр
Не используйте пневмококковую вакцину по истечении срока годности, указанного на этикетке.
Перед введением визуально осмотрите вакцину на наличие твердых частиц и/или изменение цвета.
 Если эти условия существуют, НЕ используйте.
Если эти условия существуют, НЕ используйте.Путь введения, место и размер иглы
Введение пневмококковой полисахаридной вакцины (PPSV23) внутримышечно или подкожно. Введите пневмококковые конъюгированные вакцины (ПКВ13, ПКВ15 и ПКВ20) внутримышечно. Предпочтительным местом для вакцинации против ЦВС-13 или ЦВС-15 у младенцев и детей младшего возраста является латеральная широкая мышца бедра в переднебоковой области. Дельтовидная мышца является предпочтительным местом инъекции для вакцинации PCV13 или PCV15 у детей старшего возраста и вакцинации PCV15 или PCV20 у взрослых. Используйте длину иглы, соответствующую возрасту и размеру человека, получающего вакцину.
Количество и время введения доз
Первичная серия ПКВ13 или ПКВ15 состоит из 3 доз, обычно вводимых в возрасте 2, 4 и 6 месяцев. Вы можете вводить первую дозу уже в возрасте 6 недель. CDC рекомендует четвертую (бустерную) дозу в возрасте от 12 до 15 месяцев. Для детей, вакцинированных в возрасте до 12 месяцев, минимальный интервал между дозами составляет 4 недели.
 Отдельные дозы вводят в возрасте 12 месяцев и старше не менее чем на 8 недель.
Отдельные дозы вводят в возрасте 12 месяцев и старше не менее чем на 8 недель.Количество и время введения доз для детей старшего возраста и взрослых зависят от медицинских показаний, предшествующей вакцинации против пневмококка и возраста. Все рекомендации по вакцинации против пневмококка в зависимости от вакцины и возраста см. в разделе Вакцинация против пневмококка: сводка о том, кого и когда вакцинировать.
Подготовка доз вакцины
Нет данных о стабильности вакцин, хранящихся в шприцах, заполненных медицинскими работниками. Таким образом, CDC не рекомендует предварительно набирать дозы вакцины. Не открывайте флаконы с вакциной до времени введения.
Введение с другими вакцинами
Никогда не вводите пневмококковую конъюгированную вакцину (PCV13, PCV15 или PCV20) и PPSV23 во время одного визита.
Если ребенку (в возрасте от 2 до 18 лет) показано введение одновременно пневмококковой конъюгированной вакцины (PCV13 или PCV15) и PPSV23, сначала введите пневмококковую конъюгированную вакцину, а затем PPSV23 не менее чем через 8 недель.
 Если PPSV23 был случайно введен первым, подождите не менее 8 недель, прежде чем вводить PCV13 или PCV15.
Если PPSV23 был случайно введен первым, подождите не менее 8 недель, прежде чем вводить PCV13 или PCV15.Таблица 1: интервал между вакцинациями по возрасту Возрастная группа Рекомендации по интервалам
(предпочтительно PCV13 или PCV15, затем PPSV23)Рекомендации по интервалам
(PPSV23, затем PCV13 или PCV15)Дети от 2 до 18 лет с определенными заболеваниями* 8 недель и более 8 недель и более Если взрослому показано введение ПКВ15 и ПВВ23, сначала введите ПКВ15, а затем ПВВ23 не менее чем через 1 год (рекомендуемый интервал). Минимальный интервал составляет 8 недель и может рассматриваться у взрослых с иммунодефицитом, кохлеарным имплантом или утечкой спинномозговой жидкости. Если PPSV23 был случайно введен первым, подождите не менее 1 года перед введением PCV15 (рекомендуемый и минимальный интервал).

Таблица 2: интервал между вакцинациями по возрасту Возрастная группа Рекомендации по интервалам†
(предпочтительнее PCV15, затем PPSV23)Рекомендации по интервалам
(PPSV23, затем PCV15)19 лет и старше с определенными заболеваниями* или другими факторами риска** 1 год или дольше 1 год или дольше 65 лет и старше 1 год или дольше 1 год или дольше * Медицинские состояния, повышающие риск развития пневмококковой инфекции, включают ликвор, хронические заболевания сердца/печени/легких, хроническую почечную недостаточность или нефротический синдром, кохлеарный имплантат, врожденную или приобретенную асплению, сахарный диабет, генерализованное злокачественное новообразование, ВИЧ-инфекцию , болезнь Ходжкина, ятрогенная иммуносупрессия, лейкемия, лимфома, множественная миелома, серповидно-клеточная анемия или другие гемоглобинопатии, трансплантация паренхиматозных органов.

** Другие факторы риска, повышающие риск развития пневмококковой инфекции, включают алкоголизм и курение сигарет.
† Минимальный интервал составляет 8 недель и может рассматриваться у взрослых с иммунодефицитом, кохлеарным имплантом или утечкой спинномозговой жидкости.Для детей
Вы можете вводить PCV13, PCV15 или PPSV23 одновременно с большинством других плановых детских прививок, за одним исключением.
- Не давать PCV13 с Menactra ® , менингококковая конъюгированная вакцина. Аналогичные меры предосторожности следует использовать для ЦВС-15. Дети с функциональной или анатомической аспленией или ВИЧ НЕ должны получать Menactra ® в возрасте до 2 лет. Это время позволяет избежать вмешательства в иммунологический ответ на серию пневмококковой конъюгированной вакцинации младенцев. CDC рекомендует детям в возрасте от 2 до 23 месяцев с функциональной или анатомической аспленией или ВИЧ получать Menveo ® .
Введение инактивированной противогриппозной вакцины с PCV13 увеличивает риск фебрильных судорог у детей согласно исследованию Vaccine Safety Datalink.
 В настоящее время нам неизвестен риск фебрильных судорог, когда ПКВ15 вводится одновременно с инактивированной противогриппозной вакциной. Однако клиницисты могут вводить конъюгированную пневмококковую вакцину одновременно с вакциной против гриппа. В исследовании рассматривалась трехвалентная инактивированная противогриппозная вакцина (TIV или IIV) и PCV13 для сезонов гриппа с 2006–07 по 2010–2011 годы и сезона 2014–2015 годов. Полученные данные показали, что PCV13 и вакцина против дифтерии, столбняка и бесклеточного коклюша (DTaP) повышают риск фебрильных судорог при введении одновременно с вакциной против гриппа. CDC обнаружил, что введение только TIV не было связано с повышенным риском фебрильных судорог (в изученные сезоны гриппа).
В настоящее время нам неизвестен риск фебрильных судорог, когда ПКВ15 вводится одновременно с инактивированной противогриппозной вакциной. Однако клиницисты могут вводить конъюгированную пневмококковую вакцину одновременно с вакциной против гриппа. В исследовании рассматривалась трехвалентная инактивированная противогриппозная вакцина (TIV или IIV) и PCV13 для сезонов гриппа с 2006–07 по 2010–2011 годы и сезона 2014–2015 годов. Полученные данные показали, что PCV13 и вакцина против дифтерии, столбняка и бесклеточного коклюша (DTaP) повышают риск фебрильных судорог при введении одновременно с вакциной против гриппа. CDC обнаружил, что введение только TIV не было связано с повышенным риском фебрильных судорог (в изученные сезоны гриппа).Нет известных побочных эффектов на иммуногенность или безопасность при одновременном введении ПКВ13 с вакцинами, содержащими следующие антигены:
- Дифтерия, столбняк или бесклеточный коклюш
- Haemophilus influenzae тип b
- Инактивированный полиомиелит
- Ротавирус
- Гепатит В
- Менингококки серогруппы С
- Корь, эпидемический паротит, краснуха или ветряная оспа
Данные клинических испытаний PCV15 показали иммуногенность и безопасность ответов, которые были аналогичны ответам у детей, получавших PCV13, когда PCV13 или PCV15 вводили одновременно со следующими антигенами:
- Haemophilus influenzae тип b
- Ротавирус
- Гепатит А
- Гепатит В
- Корь, эпидемический паротит, краснуха или ветряная оспа
В настоящее время нет данных клинических испытаний совместного введения PPSV23 с другими детскими вакцинами во время одного визита.

Для взрослых
Взрослым можно ввести пневмококковую вакцину (PCV15, PCV20 или PPSV23) во время одного визита с вакцинацией против гриппа. Вводите каждую вакцину отдельным шприцем и, если возможно, в разные места инъекции. Ежегодная вакцинация против гриппа важна для профилактики гриппа. Кроме того, поскольку грипп увеличивает риск заражения пневмококковой инфекцией, вакцинация против гриппа важна для предотвращения пневмококковой инфекции.
- В настоящее время нет данных о введении ПКВ15 или ПКВ20 во время одного визита с другими вакцинами (например, противостолбнячной, дифтерийной и бесклеточной коклюшной вакциной или вакциной против опоясывающего лишая) среди взрослых.
- Рандомизированное клиническое исследование показало, что одновременное введение PPSV23 и вакцины против опоясывающего лишая приводит к снижению иммунного ответа на опоясывающий лишай по сравнению с лицами, которые получали эти вакцины с интервалом в 4 недели. Тем не менее, чтобы избежать создания барьеров для вакцинации, CDC продолжает рекомендовать введение вакцины против опоясывающего лишая и PPSV23 во время одного и того же визита, если человек имеет право на обе вакцины.

Прививки | TRICARE
Покрываемые услуги
Узнайте больше о том, что мы покрываем —
, включая здравоохранение, стоматологию и фармацию.Нужен крупный текст?
TRICARE покрывает соответствующие возрасту дозы вакцин в соответствии с рекомендациями Центров по контролю и профилактике заболеваний (CDC).
- TRICARE регулярно увеличивает покрытие для новых вакцин на основе рекомендаций CDC.
- Вы также можете поговорить со своим поставщиком медицинских услуг или региональным подрядчиком, чтобы узнать, покрывается ли страховым покрытием необходимая вам вакцина.
Получение вакцины в военном госпитале или клинике
Обратитесь в местный военный госпиталь или клинику, чтобы получить инструкции по вакцинам и их наличие.
Получение вакцин от уполномоченного поставщика TRICAREУполномоченным поставщиком является любое лицо, учреждение/организация или поставщик, которые имеют государственную лицензию, аккредитованы национальной организацией или соответствуют другим стандартам медицинского сообщества и сертифицированы для предоставления льгот в соответствии с TRICARE.
 Существует два типа авторизованных TRICARE поставщиков: сетевые и несетевые. ДС
Существует два типа авторизованных TRICARE поставщиков: сетевые и несетевые. ДСВы можете получить покрываемые вакцины у любого поставщика, уполномоченного TRICARE. TRICARE покрывает вакцины бесплатно. Но когда вы получаете вакцину от своего поставщика услуг, вам, возможно, придется внести доплату или долевое участие в оплате визита в офис или за другие услуги, полученные во время визита в офис. Ваша доплатаФиксированная сумма в долларах, которую вы можете заплатить за покрываемые медицинские услуги или лекарства. и доля затратПроцент от общей стоимости покрываемых медицинских услуг, которую вы оплачиваете. суммы варьируются в зависимости от вашего плана.
Вы зарегистрированы в программе Prime? Обратитесь к своему основному лечащему врачу или сетевому поставщику медицинских услуг, чтобы избежать платы за обслуживание в пунктах обслуживания .
Получение вакцин в сетевых аптеках
Вы можете получить некоторые покрываемые вакцины за 0 долларов США в сетевых аптеках, участвующих в программе.
 Чтобы найти аптеку, участвующую в программе вакцинации:
Чтобы найти аптеку, участвующую в программе вакцинации:- Поиск в Интернете или
- Звоните 1-877-363-1303
Обязательно сначала позвоните в аптеку по номеру:
- Уточните дни и время, когда вы можете прийти на вакцинацию.
- Посмотрите, есть ли ограничения.
- Убедитесь, что в аптеке есть нужная вам вакцина.
- Убедитесь, что вакцины дает фармацевт, а не поставщик, чтобы избежать возможных наличных расходов.
Вакцины, необходимые для поездок за пределы США
- TRICARE покрывает эти вакцины только для членов семьи, находящихся на действительной военной службе, путешествующих со своим спонсором в связи с постоянным изменением распоряжения о месте службы или другими официальными поездками.
- Претензии должны включать копию путевых листов или другую официальную документацию для проверки требований к официальным поездкам.
Стоимость самой вакцины против COVID-19 не взимается.



 Если эти условия существуют, НЕ используйте.
Если эти условия существуют, НЕ используйте. Отдельные дозы вводят в возрасте 12 месяцев и старше не менее чем на 8 недель.
Отдельные дозы вводят в возрасте 12 месяцев и старше не менее чем на 8 недель. Если PPSV23 был случайно введен первым, подождите не менее 8 недель, прежде чем вводить PCV13 или PCV15.
Если PPSV23 был случайно введен первым, подождите не менее 8 недель, прежде чем вводить PCV13 или PCV15.
 В настоящее время нам неизвестен риск фебрильных судорог, когда ПКВ15 вводится одновременно с инактивированной противогриппозной вакциной. Однако клиницисты могут вводить конъюгированную пневмококковую вакцину одновременно с вакциной против гриппа. В исследовании рассматривалась трехвалентная инактивированная противогриппозная вакцина (TIV или IIV) и PCV13 для сезонов гриппа с 2006–07 по 2010–2011 годы и сезона 2014–2015 годов. Полученные данные показали, что PCV13 и вакцина против дифтерии, столбняка и бесклеточного коклюша (DTaP) повышают риск фебрильных судорог при введении одновременно с вакциной против гриппа. CDC обнаружил, что введение только TIV не было связано с повышенным риском фебрильных судорог (в изученные сезоны гриппа).
В настоящее время нам неизвестен риск фебрильных судорог, когда ПКВ15 вводится одновременно с инактивированной противогриппозной вакциной. Однако клиницисты могут вводить конъюгированную пневмококковую вакцину одновременно с вакциной против гриппа. В исследовании рассматривалась трехвалентная инактивированная противогриппозная вакцина (TIV или IIV) и PCV13 для сезонов гриппа с 2006–07 по 2010–2011 годы и сезона 2014–2015 годов. Полученные данные показали, что PCV13 и вакцина против дифтерии, столбняка и бесклеточного коклюша (DTaP) повышают риск фебрильных судорог при введении одновременно с вакциной против гриппа. CDC обнаружил, что введение только TIV не было связано с повышенным риском фебрильных судорог (в изученные сезоны гриппа).

 Существует два типа авторизованных TRICARE поставщиков: сетевые и несетевые. ДС
Существует два типа авторизованных TRICARE поставщиков: сетевые и несетевые. ДС Чтобы найти аптеку, участвующую в программе вакцинации:
Чтобы найти аптеку, участвующую в программе вакцинации: