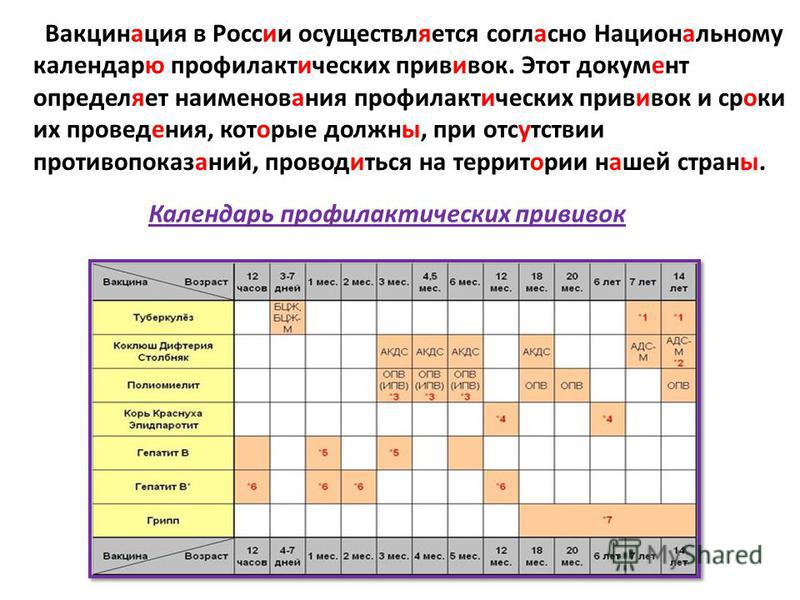
Содержание
Подготовка ребенка к прививке – Городская поликлиника №7 г. Гродно
- Перед первой прививкой АКДС-вакциной необходимо сделать общий анализ крови и мочи.
- При наличии у ребенка аллергических расстройств (диатез и др.) заранее обсудите с врачом схему профилактики обострения аллергии. Обычно она представляет собой прием антигистаминных препаратов в течение 2 дней до прививки и 2 дней после.
- Купите детские жаропонижающие с парацетамолом. Лучше покупать свечи, поскольку ароматизаторы в сиропах сами способны вызвать побочные реакции.
- В день прививки
- Не вводите новый прикорм или новые виды пищи. Если ребенок находится на грудном вскармливании — не вводите в свой рацион новые продукты.
- Не забудьте принять антигистаминные и другие препараты, которые назначил врач.
- Убедитесь, что дома есть (особенно в случае АКДС-вакцин) детские свечи с парацетамолом .
 Не полагайтесь только на гомеопатические препараты — ими можно пользоваться, но при сильных реакциях на прививки они не помогут.
Не полагайтесь только на гомеопатические препараты — ими можно пользоваться, но при сильных реакциях на прививки они не помогут. - Если ребенок достаточно взрослый — никогда, даже в шутку не пугайте ребенка прививкой.
- Если ребенок спросит про укол — будьте честны, скажите, что это может быть немного болезненным, но ведь это всего на несколько секунд.
Перед выходом из дома
- Обязательно возьмите с собой любимую игрушку или пеленку ребенка.
Перед самой прививкой
- Убедитесь совместно с врачом, что у ребенка на момент прививки нет повышения температуры. Это является единственным универсальным противопоказанием к проведению прививки.
- Поинтересуйтесь у врача от чего и какой именно вакциной сегодня будут прививать ребенка.
- Не стесняйтесь задать вопросы врачу, если у вас есть какие-то сомнения относительно прививки.

В момент укола
- Не волнуйтесь. Ваше волнение и беспокойство передаются ребенку. Будьте спокойны и уверены — и ребенок перенесет прививку гораздо легче.
- Не переживайте из-за того, что вы все же волнуетесь, просто переведите ваше волнение в конструктивное русло.
- Чтобы отвлечь ребенка (и себя) — общайтесь с ним, играйте, пойте песенки, разглядывайте предметы интерьера, играйте взятой из дома игрушкой.
- Улыбайтесь и будьте ласковы к ребенку.
- Во время укола ребенок должен быть у вас на руках — так ему и вам будет комфортнее.
- Дайте ребенку выплакаться после укола. Не заставляйте ребенка быть храбрым, не говорите, что плакать стыдно.
- Если ребенок говорит, что ему больно — выдуйте боль. Сделайте глубокий вдох и медленно выдувайте боль. Повторите это упражнение несколько раз.
После прививки
В первые 30 минут после прививки
- Не забудьте и стесняйтесь задать ваши вопросы врачу.
 Обязательно спросите о том, какие и когда реакции на прививку могут возникнуть и в каких случаях обращаться за медицинской помощью.
Обязательно спросите о том, какие и когда реакции на прививку могут возникнуть и в каких случаях обращаться за медицинской помощью. - Не торопитесь покинуть поликлинику или медицинский центр. Посидите в течение 20-30 минут неподалеку от кабинета. Во-первых, это поможет успокоиться, во вторых — позволит быстро оказать помощь в случае возникновения немедленных аллергических реакций на прививку.
- Если ребенок находится на грудном вскармливании — дайте ему грудь, это поможет ему успокоиться.
- Если ребенок достаточно взрослый, порадуйте его каким-нибудь приятным сюрпризом, наградите его чем-нибудь, похвалите. Скажите ему, что все в порядке.
По возвращении домой после прививки
- В случае прививки АКДС-вакциной: если врачом не было предписано иначе, дайте ребенку дозу (свечку или сироп) жаропонижающего. Это позволит избежать неприятных реакций, возникающих в первые часы после прививки.

Первая ночь после прививки
- Чаще всего, температурные реакции на инактивированные вакцины (АКДС и другие) возникают в первые сутки после прививки.
- В случае АКДС-вакцин: профилактически, обязательно на ночь дайте ребенку жаропонижающее, даже если температура на данный момент нормальная. Держите под рукой анальгин.
- При температурных реакциях не пренебрегайте обтиранием ребенка теплой водой. Не используйте для обтираний водку — она раздражает и сушит детскую кожу.
- Не забывайте о том, что суточная дозировка парацетамола не безгранична. При передозировке возможны тяжелые осложнения. Внимательно прочтите инструкцию к препарату, которым пользуетесь (панадол, эффералган, тайленол).
- Ни в коем случае не пользуйтесь аспирином. Его применение у детей младшего возраста чревато тяжелыми осложнениями.
Первые два дня после прививки
(инактивированные вакцины — АКДС, АДС, гепатит В, ХИБ-вакцина, ИПВ)
- Принимайте те препараты для профилактики аллергических расстройств, которые назначил врач.

- Продолжайте принимать жаропонижающие согласно инструкции к препаратам, если температура остается повышенной.
- АКДС-вакцины. Следите за температурой тела ребенка. Старайтесь, чтобы она не поднималась выше 38,5оС (под мышкой). У части детей на фоне повышения температуры возможно появление т.н. фебрильных судорог. Принимайте жаропонижающие, не дожидаясь подъема температуры.
- С ребенком можно и нужно гулять, можно и нужно купать его. Исключение составляют случаи, когда у ребенка повышена температура вследствие или независимо от прививки.
- Если была проведена проба Манту — при купании старайтесь, чтобы вода не попадала на место постановки пробы. Не забывайте, что пот это тоже жидкость, поэтому следите за тем, чтобы ручка ребенка не потела.
- Не вводите новых продуктов в рацион ребенка (и свой, если ребенок находится на грудном вскармливании). Это можно будет сделать на 3-и сутки после прививки и позже.
- В случае АКДС-, АДС-, гепатитных В и АДС-М-вакцин.
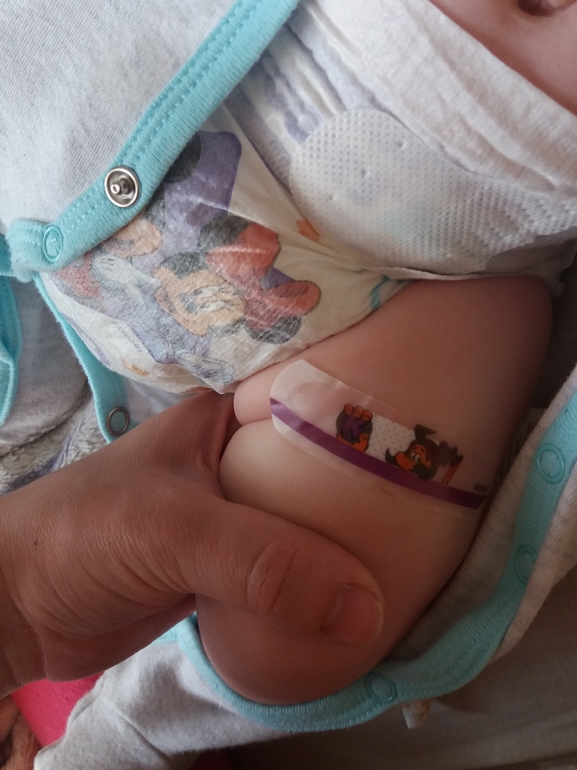
 При появлении сильных реакций в месте укола (припухлость, уплотнение, покраснение) сделайте согревающий компресс или просто периодически прикладывайте смоченную водой ткань. Если противовоспалительные средства еще не принимаются, начните их давать.
При появлении сильных реакций в месте укола (припухлость, уплотнение, покраснение) сделайте согревающий компресс или просто периодически прикладывайте смоченную водой ткань. Если противовоспалительные средства еще не принимаются, начните их давать.
Через 5-12 дней после прививки
- В случае прививки живыми вакцинами (капли полиомиелитной вакцины ОПВ, коревая, паротитная, краснушная) побочные реакции обычно возникают на 5-12 сутки после прививки.
- Если возникла какая-либо реакция, но прививка была сделана не живой вакциной, то вакцинация с 99% вероятностью здесь ни при чем. Наиболее частой причиной температурных и некоторых других реакций у детей младшего возраста являются режущиеся зубки, у детей старшего возраста — простудные инфекции.
Комбинированные вакцины – PMC
1. Эдвардс К.М., Декер М.Д. Вакцина. В: Плоткин С.А., Оренштейн В.А., Оффит П., ред. Вакцина против коклюша. 5-е изд. США: Сондерс, Пенсильвания; 2008.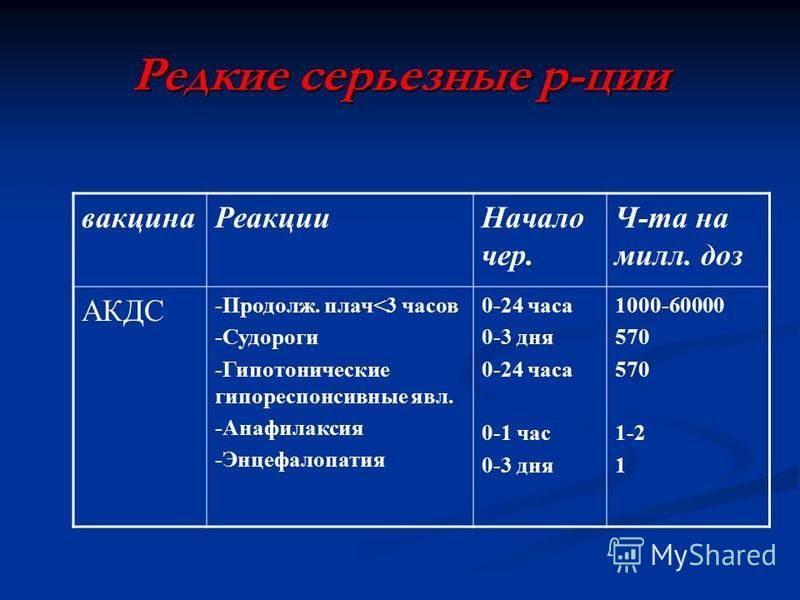 стр. 471–528. [Google Scholar]
стр. 471–528. [Google Scholar]
2. Рекомендуемый график прививок для лиц в возрасте от 0 до 6 лет. Центры по контролю и профилактике заболеваний — США. 2010 [Google Scholar]
3. Marshall GS, Happe LE, Lunacsek OE, Szymanski MD, Woods CR, Zahn M, et al. Использование комбинированных вакцин связано с улучшенными показателями охвата. Pediatr Infect Dis J. 2007;26:496–500. [PubMed] [Google Scholar]
4. Kalies H, Grote V, Verstraeten T, Hessel L, Schmitt HJ, von Kries R. Использование комбинированных вакцин улучшило своевременность вакцинации детей. Pediatr Infect Dis J. 2006; 25: 507–12. [PubMed] [Google Scholar]
5. Weston WM, Klein NP. Kinrix: новая комбинированная вакцина DTaPIPV для детей в возрасте 46 лет. Эксперт Rev Вакцины. 2008; 7: 1309–20. [PubMed] [Google Scholar]
6. Zepp F, Schmitt HJ, Cleerbout J, Verstraeten T, Schuerman L, Jacquet JM. Обзор 8-летнего опыта применения Infanrix hexa (гексавалентная вакцина DTPaHBVIPV/Hib) Expert Rev Vaccines. 2009 г.;8:663–78. [PubMed] [Google Scholar]
2009 г.;8:663–78. [PubMed] [Google Scholar]
7. Bogaerts H. Будущее детской иммунизации: изучение европейского опыта. Am J Manag Care. 2003;9:С30–6. [PubMed] [Google Scholar]
8. Уайт С., Гальперин С.А., Шайфеле Д.В. Детская комбинированная вакцина DTaPIPV/Hib. Эксперт Rev Вакцины. 2009; 8: 831–40. [PubMed] [Google Scholar]
9. Schmitt HJ. США: Сан-Франциско, Калифорния; 1995. Иммуногенность и реактогенность двух конъюгированных вакцин против столбняка Haemophilus influenzae типа b, вводимых путем восстановления дифтерийно-столбнячно-бесклеточной коклюшной вакциной или в виде отдельных инъекций. В 35 -я Межнаучная конференция по противомикробным препаратам и химиотерапии (ICAAC) Иммуногенность и реактогенность двух конъюгированных вакцин против столбняка Haemophilus influenzae типа b, вводимых путем восстановления дифтерийно-столбнячно-коклюшной бесклеточной вакциной или вводимых в виде отдельных инъекций 35-я Межнаучная конференция по противомикробным препаратам Агенты и химиотерапия (ICAAC) Сан-Франциско, Калифорния, США; 1995. [Google Scholar]
[Google Scholar]
10. Эскола Дж., Уорд Дж., Даган Р., Голдблатт Д., Зепп Ф., Зигрист К.А. Комбинированная вакцинация конъюгатом Haemophilus influenzae типа b и дифтерийно-столбнячно-коклюшной, содержащей бесклеточный коклюш. Ланцет. 1999;354:2063–8. [PubMed] [Google Scholar]
11. Slack MH, Schapira D, Thwaites RJ, Burrage M, Southern J, Andrews N, et al. Иммунный ответ недоношенных детей на менингококковую серогруппу С и комбинированные дифтерийно-столбнячные анатоксины, бесклеточные коклюшно-гемофильные конъюгированные вакцины типа b. J заразить дис. 2001; 184:1617–20. [PubMed] [Google Scholar]
12. Schmitt HJ, Knuf M, Ortiz E, Sänger R, Uwamwezi MC, Kaufhold A. Первичная вакцинация младенцев дифтерией-столбняком-бесклеточным коклюшем-гепатитом B, инактивированным вирусом полиомиелита и Haemophilus вакцины против гриппа типа b, вводимые в виде отдельных или смешанных инъекций. J Педиатр. 2000; 137: 304–12. [PubMed] [Академия Google]
13. Декер, доктор медицины. Принципы педиатрических комбинированных вакцин и практические вопросы, связанные с использованием в клинической практике. Pediatr Infect Dis J. 2001; 20: S10–8. [PubMed] [Google Scholar]
Принципы педиатрических комбинированных вакцин и практические вопросы, связанные с использованием в клинической практике. Pediatr Infect Dis J. 2001; 20: S10–8. [PubMed] [Google Scholar]
14. Даган Р., Пулман Дж.Т., Зепп Ф. Комбинированные вакцины, содержащие DTPa-Hib: влияние ИПВ и одновременного введения конъюгатов CRM197. Эксперт Rev Вакцины. 2008; 7: 97–115. [PubMed] [Google Scholar]
15. Decker MD, Edwards KM, Bogaerts HH. Комбинированные вакцины. В: Плоткин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. США: Сондерс, Пенсильвания; 2008. С. 1069.–101. [Google Scholar]
16. Мавас Ф., Дикинсон Р., Дуглас-Бардсли А., Син Д.К., Сесардик Д., Корбел М.Дж. Иммунное взаимодействие между компонентами бесклеточной коклюшно-дифтерийно-столбнячной (DTaP) вакцины и конъюгированной вакцины против Haemophilus influenzae b (Hib) на крысиной модели. вакцина. 2006; 24:3505–12. [PubMed] [Google Scholar]
17. Schutze MP, Deriaud E, Przewlocki G, LeClerc C. Супрессия эпитопа, индуцированная носителем, инициируется клональным доминированием. Дж Иммунол. 1989; 142: 2635–40. [PubMed] [Академия Google]
Дж Иммунол. 1989; 142: 2635–40. [PubMed] [Академия Google]
18. McGuirk P, Johnson PA, Ryan EJ, Mills KH. Нитевидный гемагглютинин и коклюшный токсин Bordetella pertussis модулируют иммунный ответ на неродственные антигены. J заразить дис. 2000; 182:1286–8. [PubMed] [Google Scholar]
19. Ramsay ME, McVernon J, Andrews NJ, Heath PT, Slack MP. Оценка эффективности вакцин против Haemophilus influenzae типа b в Англии и Уэльсе с использованием метода скрининга. J заразить дис. 2003; 188: 481–5. [PubMed] [Google Scholar]
20. Фитцджеральд М., Кэнни М., О’Фланаган Д. Наверстывающая кампания по вакцинации в ответ на недавний рост заболеваемости Hib-инфекцией в Ирландии. Евронаблюдение. 2005;10:E050929–2. [PubMed] [Google Scholar]
21. Steinhoff M, Goldblatt D. Конъюгированные HIB-вакцины. Ланцет. 2003; 361:360–1. [PubMed] [Google Scholar]
22. Bettinger JA, Halperin SA, De Serres G, Scheifele DW, Tam T. Влияние перехода от цельноклеточной коклюшной вакцины к бесклеточной на эпидемиологию госпитализированных детей с коклюшем в Канаде. Pediatr Infect Dis J. 2007; 26:31–5. [PubMed] [Google Scholar]
Pediatr Infect Dis J. 2007; 26:31–5. [PubMed] [Google Scholar]
23. Маст Э., Махони Ф., Кейн М., Марголис Х. Вакцина против гепатита В. В: Плотскин С.А., Оренштейн В.А., Оффит П.А., ред. Вакцина. 5-е изд. США: Сондерс, Пенсильвания; 2008. стр. 205–241. [Академия Google]
24. Гринберг Д.П., Вонг В.К., Партридж С., Чанг С.Дж., Цзин Дж., Хоу Б.Дж. и соавт. Иммуногенность конъюгированной вакцины против гемофильной палочки типа b и столбнячного анатоксина при смешивании с комбинированной вакциной против дифтерии, столбняка, бесклеточного коклюша и гепатита В. Pediatr Infect Dis J. 2000;19:1135–40. [PubMed] [Google Scholar]
25. Гринберг Д.П., Вонг В.К., Партридж С., Хоу Б.Дж., Уорд Дж.И. Безопасность и иммуногенность комбинированной вакцины против дифтерийно-столбнячного анатоксина, бесклеточного коклюша и гепатита В, вводимой в возрасте двух, четырех и шести месяцев, по сравнению с моновалентной вакциной против гепатита В, вводимой при рождении, в возрасте одного месяца и шести месяцев. Pediatr Infect Dis J. 2002; 21:769–77. [PubMed] [Google Scholar]
Pediatr Infect Dis J. 2002; 21:769–77. [PubMed] [Google Scholar]
26. Pichichero ME, Blatter MM, Reisinger KS, Harrison CJ, Johnson CE, Steinhoff MC, et al. Влияние дозы вакцины против гепатита В при рождении на реактогенность и иммуногенность комбинированной вакцины против дифтерии, столбняка, бесклеточного коклюша, гепатита В, инактивированного полиовируса и гемофильной палочки типа b. Pediatr Infect Dis J. 2002;21:854–9. [PubMed] [Google Scholar]
27. Европейское агентство по оценке лекарственных средств (EMEA). Европейское агентство по лекарственным средствам рекомендует приостановить прием Hexavac. 2005. [последний доступ январь 2010]. Доступна с:
http://www.emea.europa.eu/humandocs/PDFs/EPAR/Hexavac/29736905en.pdf .
28. Zanetti AR, Mariano A, Romanò L, D’Amelio R, Chironna M, Coppola RC, et al. Долгосрочная иммуногенность вакцинации против гепатита В и политика ревакцинации: итальянское многоцентровое исследование. Ланцет. 2005; 366:1379–84. [PubMed] [Google Scholar]
29. Да Вилья Г., Романо Л., Сепе А., Иорио Р., Парибелло Н., Заппа А. и др. Влияние вакцинации против гепатита В в высокоэндемичном районе на юге Италии и долгосрочная продолжительность анти-HBs-антител в двух когортах вакцинированных лиц. вакцина. 2007; 25:3133–6. [PubMed] [Академия Google]
Да Вилья Г., Романо Л., Сепе А., Иорио Р., Парибелло Н., Заппа А. и др. Влияние вакцинации против гепатита В в высокоэндемичном районе на юге Италии и долгосрочная продолжительность анти-HBs-антител в двух когортах вакцинированных лиц. вакцина. 2007; 25:3133–6. [PubMed] [Академия Google]
30. Центры по контролю и профилактике заболеваний – CDC. Вакцинация против коклюша: бесклеточная вакцина против коклюша для подкрепляющего и бустерного использования — дополнительное заявление ACIP. Рекомендации Консультативного комитета по практике иммунизации (ACIP). 1992. Еженедельный отчет о заболеваемости и смертности (MMWR) Recomm. Отчет 41 (RR-1): 1–10. [PubMed] [Google Scholar]
31. Cohen R, Schuerman L. Реактогенность новых вакцин DTPa-HBV-IPV (+ и /Hib) после первичных и бустерных доз. Представлено по адресу: 18 th Annual Meeting of the European Society for Pediatric Infectious Diseases (ESPID) Noordwijk, The Netherlands, 2000 [Google Scholar]
32. Braun MM, Mootrey GT, Salive ME, Chen RT, Ellenberg SS. Иммунизация младенцев бесклеточными вакцинами против коклюша в Соединенных Штатах: оценка данных за первые два года из Системы отчетности о побочных эффектах вакцин (VAERS) Pediatrics. 2000;106:E51. [PubMed] [Google Scholar]
Иммунизация младенцев бесклеточными вакцинами против коклюша в Соединенных Штатах: оценка данных за первые два года из Системы отчетности о побочных эффектах вакцин (VAERS) Pediatrics. 2000;106:E51. [PubMed] [Google Scholar]
33. Deloria MA, Blackwelder WC, Decker MD, Englund JA, Steinhoff MC, Pichichero ME, et al. Ассоциация реакций после последовательных иммунизаций бесклеточной или цельноклеточной коклюшной вакциной. Педиатрия. 1995;96:592. [PubMed] [Google Scholar]
34. Rennels MB, Deloria MA, Pichichero ME, Losonsky GA, Englund JA, Meade BD, et al. Обширный отек после бустерных доз бесклеточных коклюшно-столбнячно-дифтерийных вакцин. Педиатрия. 2000;105:e12. [PubMed] [Google Scholar]
35. Schmitt HJ, Beutel K, Schuind A, Knuf M, Wagner S, Müschenborn S, et al. Реактогенность и иммуногенность бустерной дозы комбинированной дифтерийно-столбнячной и трехкомпонентной бесклеточной коклюшной вакцины в возрасте от четырнадцати до двадцати восьми месяцев. J Педиатр. 1997;130:616–23. [PubMed] [Google Scholar]
1997;130:616–23. [PubMed] [Google Scholar]
36. Scheifele DW, Halperin SA, Ferguson AC. Оценка реакций в месте инъекции бесклеточной комбинированной вакцины на основе коклюша, включая новое использование кожных тестов с вакцинными антигенами. вакцина. 2001;19:4720–6. [PubMed] [Google Scholar]
37. Реннелс МБ. Обширные реакции отека, возникающие после бустерных доз дифтерийно-столбнячно-бесклеточной коклюшной вакцины. Семинары по детской инфекционной патологии. 2003; 14:196–8. [PubMed] [Академия Google]
38. Rowe J, Yerkovich ST, Richmond P, Suriyaarachchi D, Fisher E, Feddema L, et al. Th3-ассоциированные местные реакции на бесклеточную противодифтерийно-столбнячно-коклюшную вакцину у детей 4–6 лет. Заразить иммун. 2005;73:8130–5. [Статья бесплатно PMC] [PubMed] [Google Scholar]
39. Southern J, Andrews N, Burrage M, Miller E. Иммуногенность и реактогенность комбинированных бесклеточных вакцин против коклюша/столбняка/дифтерии в малых дозах, вводимых в качестве бустерной вакцины британским подросткам. вакцина. 2005;23:3829–35. [PubMed] [Google Scholar]
вакцина. 2005;23:3829–35. [PubMed] [Google Scholar]
40. Tichmann-Schumann I, Soemantri P, Behre U, Dissselhoff J, Mahler H, Maechler G, et al. Иммуногенность и реактогенность четырех доз дифтерийно-столбнячной трехкомпонентной бесклеточной коклюшно-гепатитной В-инактивированной полиовирусной гемофильной вакцины типа b при совместном введении с 7-валентной пневмококковой конъюгированной вакциной. Pediatr Infect Dis J. 2005; 24:70–7. [PubMed] [Google Scholar]
41. Использование вакцины против дифтерийного анатоксина, столбнячного анатоксина и бесклеточной коклюшной вакцины в виде серии из пяти доз. Дополнительные рекомендации Консультативного комитета по практике иммунизации (ACIP), MMWR Recomm Rep. 2000;49: 1–8. [PubMed] [Google Scholar]
42. Герц А., Блэк С., Шайнфилд Х., Норьега Ф., Гринберг Д. Ежегодное собрание педиатрических академических обществ. США: Вашингтон, округ Колумбия; 2005. Май, Безопасность комбинированного DTaP-IPV + PRP-T (Pentacel™), вводимого в возрасте 2, 4, 6 и от 15 до 18 месяцев; стр. 14–17. [Google Scholar]
14–17. [Google Scholar]
43. Huang LM, Chang LY, Tang H, Bock HL, Lu CY, Huang FY, et al. Иммуногенность и реактогенность вакцины против дифтерии, столбняка и бесклеточного коклюша с пониженным содержанием антигена у здоровых тайваньских детей и подростков. Дж Адолеск Здоровье. 2005; 37:517. [PubMed] [Академия Google]
44. Kosuwon P, Warachit B, Hutagalung Y, Borkird T, Kosalaraksa P, Bock HL, et al. Реактогенность и иммуногенность дифтерийно-столбнячно-бесклеточной коклюшной вакцины (dTpa) со сниженным содержанием антигена, вводимой в качестве бустерной вакцины детям 4-6 лет, привитым четырьмя дозами цельноклеточной коклюшной вакцины. вакцина. 2003; 21:4194–200. [PubMed] [Google Scholar]
45. Sänger R, Behre U, Krause KH, Loch HP, Soemantri P, Herrmann D, et al. Бустерная вакцинация и последующее наблюдение в течение 1 года за детьми в возрасте 4–8 лет с вакциной dTpa-IPV с пониженным содержанием антигена. Eur J Педиатр. 2007;166:1229–36. [PubMed] [Google Scholar]
46. Программа плановой иммунизации детей NHS, январь 2008 г. [последний доступ январь 2010 г.]. Доступно по адресу: http://www.immunisation.nhs.uk/immunisation_schedule.
Программа плановой иммунизации детей NHS, январь 2008 г. [последний доступ январь 2010 г.]. Доступно по адресу: http://www.immunisation.nhs.uk/immunisation_schedule.
47. Институт Роберта Коха. Рекомендация Постоянного комитета по вакцинации (STIKO) Института Роберта Коха по вакцинации против коклюша. Эпидемиологический бюллетень. 2006; 3:21–3. [Google Scholar]
48. Scheifele DW, Halperin SA, Smith B, Ochnio J, Meloff K, Duarte-Monteiro D. Оценка совместимости совместно вводимого 7-валентного пневмококкового конъюгата DTaP.IPV/PRP-T Hib и вакцины против гепатита В у младенцев в возрасте 2-7 месяцев. вакцина. 2006; 24:2057–64. [PubMed] [Академия Google]
49. Норьега Ф., Цанг П., Джемиоло Д., Волошен Т., Гринберг Д.П. 5-я -я -я Конференция по инфекционным заболеваниям детей. 5-е изд. США: Напа, Калифорния; 2005. Октябрь, Исследовательская группа Pentacel Investigators. Иммуногенность серии из четырех доз DTaP-IPV//PRP-T (Pentacel™) [Google Scholar]
50. Профилактика пневмококковой инфекции: рекомендации Консультативного комитета по практике иммунизации (ACIP) MMWR Recomm Rep. 1997; 46:1–24. [PubMed] [Google Scholar]
Профилактика пневмококковой инфекции: рекомендации Консультативного комитета по практике иммунизации (ACIP) MMWR Recomm Rep. 1997; 46:1–24. [PubMed] [Google Scholar]
51. Knuf M, Habermehl P, Cimino C, Petersen G, Schmitt HJ. Иммуногенность, реактогенность и безопасность 7-валентной пневмококковой конъюгированной вакцины (ПКВ7), вводимой одновременно с комбинированной вакциной DTPa-HBV-IPV/Hib у здоровых детей раннего возраста. вакцина. 2006; 24:4727–36. [PubMed] [Академия Google]
52. Тоцци А.Е., Аззари С., Бартолоцци Г., Эспозито С., Фара Г.М., Джудиче М.Л. Можно ли одновременно вводить шестивалентные вакцины с пневмококковой или менингококковой конъюгированной вакциной? Гум Вакцина. 2007; 3: 252–9. [PubMed] [Google Scholar]
53. Tejedor JC, Omeñaca F, García-Sicilia J, Verdaguer J, Van Esso D, Esporrín C, et al. Иммуногенность и реактогенность трехдозового курса первичной вакцинации комбинированной вакциной против дифтерии-столбняка-ацеллюлярного коклюша-гепатита В-инактивированной полио-гемофильной вакцины типа В при одновременном введении с конъюгированной менингококковой вакциной С. Pediatr Infect Dis J. 2004; 23:1109–15. [PubMed] [Google Scholar]
Pediatr Infect Dis J. 2004; 23:1109–15. [PubMed] [Google Scholar]
54. Schmitt HJ, Habermehl P, Knuf M, Ypma E, Borkowski A. Испания: Валенсия; 2005. 18-20 мая, Безопасная реактогенность и иммуногенность / праймирование после введения 2 или 3 доз менингококковой конъюгированной вакцины С (MCC) одновременно с вакциной DTaP-IPV-HBV/Hib младенцам в 23 rd Annual Meeting of the Европейское общество детских инфекционных заболеваний (ESPID) [Google Scholar]
55. Schmitt HJ, Maechler G, Habermehl P, Knuf M, Saenger R, Begg N, et al. Иммуногенность, реактогенность и иммунная память после первичной вакцинации новой конъюгированной вакциной Haemophilus influenzae-Neisseria meningitidis серогруппы C. Клин Вакцина Иммунол. 2007; 14: 426–34. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Tejedor JC, Moro M, Ruiz-Contreras J, Castro J, Gómez-Campderá JA, Navarro ML, et al. Иммуногенность и реактогенность первичной иммунизации шестивалентной дифтерийно-столбнячно-бесклеточной коклюшно-гепатитной В-инактивированной полиомиелитной вакциной Haemophilus influenzae типа В, вводимой совместно с двумя дозами конъюгированной вакцины против менингококкового С-столбнячного анатоксина. Pediatr Infect Dis J. 2006; 25: 713–20. [PubMed] [Google Scholar]
Pediatr Infect Dis J. 2006; 25: 713–20. [PubMed] [Google Scholar]
57. Halperin SA, McDonald J, Samson L, Danzig L, Santos G, Izu A, et al. Одновременное введение конъюгированной вакцины против менингококка С и конъюгированной вакцины против дифтерийно-столбнячного коклюша-инактивированного полиовируса и гемофильной палочки типа b у детей: рандомизированное двойное слепое исследование. Клин Инвест Мед. 2002; 25: 243–51. [PubMed] [Академия Google]
58. Гаспарини Р., Конверсано М., Бона Г., Габутти Г., Анемона А., Дулл П. и соавт. Грац: Австрия; 2008. Иммуногенность и безопасность MenACWY-CRM, новой четырехвалентной менингококковой конъюгированной вакцины, вводимой одновременно с Tdap здоровым субъектам в возрасте 11–25 лет. Представлено на: 26 th Annual Meeting of the European Society for Pediatric Infectious Diseases. [Google Scholar]
59. Даган Р., Голдблатт Д., Малекар Дж. Р., Яич М., Эскола Дж. Снижение гуморального ответа на 11-валентную пневмококковую вакцину, вводимую совместно с вакциной, содержащей бесклеточные компоненты коклюша. Заразить иммун. 2004; 72: 5383–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 2004; 72: 5383–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Baraldo K, Mori E, Bartoloni A, Petracca R, Giannozzi A, Norelli F, et al. Полиэпитоп N19 как носитель для повышения иммуногенности и протективной эффективности менингококковых конъюгированных вакцин. Заразить иммун. 2004;72:4884–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Baraldo K, Mori E, Bartoloni A, Norelli F, Grandi G, Rappuoli R, et al. Комбинированные конъюгированные вакцины: повышенная иммуногенность с полиэпитопом N19 в качестве белка-носителя. Заразить иммун. 2005; 73: 5835–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. О’Хаган Д.Т., Де Грегорио Э. Путь к успешному адъюванту вакцины – «Долгая и извилистая дорога» Лекарство Discov Today. 2009; 14: 541–51. [PubMed] [Google Scholar]
63. Singh M, Ugozzoli M, Kazzaz J, Chesko J, Soenawan E, Mannucci D, et al. Предварительная оценка адъювантов, альтернативных квасцам, с использованием ряда известных и вакцинных антигенов нового поколения. вакцина. 2006; 24:1680–6. [PubMed] [Google Scholar]
вакцина. 2006; 24:1680–6. [PubMed] [Google Scholar]
64. Coombes L, Stickings P, Tierney R, Rigsby P, Sesardic D. Разработка и использование романа Анализ in vitro для тестирования анатоксина дифтерии в комбинированных вакцинах. Дж Иммунол Методы. 2009; 350:142–9. [PubMed] [Google Scholar]
65. Cuervo ML, Sterling AL, Nicot IA, Rodríguez MG, García OR. Валидация новой альтернативы для определения активности in vitro в вакцинах, содержащих гепатит В, от двух разных производителей. Биопрепараты. 2008; 36: 375–82. [PubMed] [Google Scholar]
66. Giffroy D, Mazy C, Duchêne M. Валидация нового метода ELISA для in vitro анализ эффективности вакцин, содержащих гепатит В. ФармЕвропа Био. 2006; 2006: 7–14. [PubMed] [Google Scholar]
67. Приер С., Брок С., Гал М., Пуарье Б., Фукс Ф. Развитие науки и прекращение использования лабораторных животных для разработки и контроля вакцин и гормонов. В: Браун Ф., Хендриксен С., Сесардик Д., Касслер К. , редакторы. Разработка теста эффективности вакцин против столбняка in vitro. Базель: публикация S. Karger AG; 2002. с. 37. [Google Академия]
, редакторы. Разработка теста эффективности вакцин против столбняка in vitro. Базель: публикация S. Karger AG; 2002. с. 37. [Google Академия]
68. Xing DK, McLellan K, Corbel MJ, Sesardic D. Оценка антигенного столбнячного анатоксина, извлеченного из биоразлагаемых микросфер. Биопрепараты. 1996; 24:57–65. [PubMed] [Google Scholar]
69. Bolgiano B, Fowler S, Turner K, Sesardic D, Xing DK, Crane DT, et al. Мониторинг дифтерийного, коклюшного и столбнячного анатоксина с помощью кругового дихроизма, флуоресцентной спектроскопии и эксклюзионной хроматографии. В: Браун Ф., Корбел М.Дж., Гриффитс Э., редакторы. Физико-химические методы характеристики вакцин. С. Каргер АГ Базель; 2000. с. 51. [PubMed] [Google Scholar]
70. Линарс П.П., Керстен Г.Ф., де Брюйн М.Л., Хендриксен С.Ф. Подход in vitro к контролю качества анатоксинных вакцин. вакцина. 2001; 19: 2729–33. [PubMed] [Google Scholar]
71. Metz B, Jiskoot W, Hennink WE, Crommelin DJ, Kersten GF. Физико-химические и иммунохимические методы позволяют прогнозировать качество вакцин против дифтерии. вакцина. 2003; 22: 156–67. [PubMed] [Google Scholar]
вакцина. 2003; 22: 156–67. [PubMed] [Google Scholar]
72. Metz B, Jiskoot W, Mekkes D, Kingma R, Hennink WE, Crommelin DJ, et al. Контроль качества рутинных, экспериментальных и выдержанных в реальном времени дифтерийных анатоксинов по in vitro аналитические методы. вакцина. 2007; 25: 6863–71. [PubMed] [Google Scholar]
73. Zhu D, Huang S, Gebregeorgis E, McClellan H, Dai W, Miller L, et al. Разработка прямого иммуноанализа состава алгидрогеля (DAFIA) J Immunol Methods. 2009; 344:73–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Блог | Краткая история вакцин
Вакцины имеют
произвел революцию в глобальном здравоохранении, уничтожив такие вирусы, как оспа и почти
ликвидации полиовируса — болезни, от которой ранее умирали миллионы людей.
Число людей, которые заражаются предотвратимыми инфекционными заболеваниями, такими как корь,
дифтерия и коклюш находятся на рекордно низком уровне благодаря вакцинам.
Вакцина от COVID-19 начала распространяться по всей
мир в декабре 2020 года, почти через год после того, как болезнь была впервые обнаружена
как вспышка в Ухане, Китай.
COVID-19
вакцины распределяются в приоритетном порядке, иммунизируя здравоохранение
профессионалы, передовые работники и наиболее уязвимые в первую очередь. COVID-19
вакцина была запущена в ускоренном режиме, но она все еще разрабатывалась в соответствии с теми же
строгим процессом являются все современные вакцины, которые доказали свою безопасность и
эффективен десятилетиями.
Какие шаги идут
в разработку вакцины? А когда была изобретена первая вакцина? Были
ответить на эти вопросы, взглянув на историю вакцин и то, как
они сделали мир более здоровым местом.
Когда были изобретены вакцины?
При взгляде на
хронологию истории вакцин можно начать в 15 -м -м веке
Китай. Китайцы признали, что люди, пережившие оспу, не
опять болезнь. Они решили брать струпья оспы у людей, переболевших легкой
случаи, высушите их, измельчите в порошок и вдуйте порошок в ноздри
здоровых людей. Эффективность этих усилий по ранней вакцинации не
хорошо известны, но у них была правильная идея: взять более слабую версию вируса,
и знакомить с ним здоровых людей, чтобы их иммунная система могла укрепиться.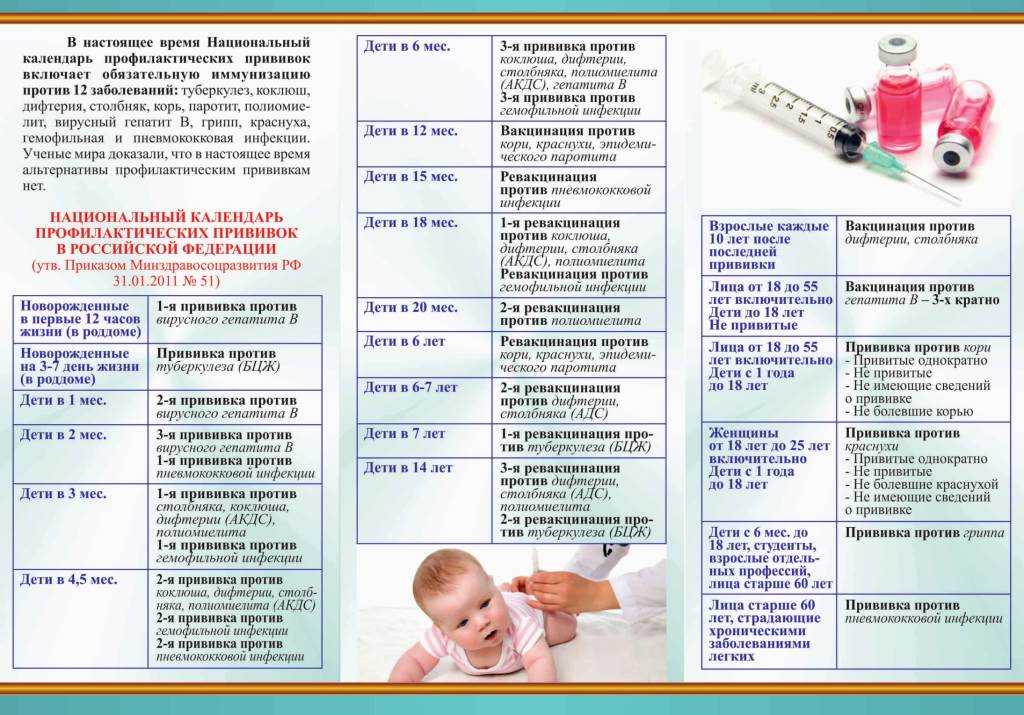
антитела (клетки, которые борются с вирусом).
Когда была создана первая вакцина?
Подробнее
Изощренный взгляд на прививки восходит к концу 18 го века.
С этого момента вакцины сделали стремительный прогресс. Вот посмотрите на
график вакцинации за последние 225 лет.
- 1796 — Доктор Эдвард Дженнер собрал кусочки
пустула коровьей оспы — животный вариант оспы — из руки доярки
назвал Сару Нельмес и нацарапал его на руке 8-летнего мальчика. - 1881 г. — Французский биолог Луи Пастер разработал
успешная вакцина против сибирской язвы. Пастер подвергал возбудителей сибирской язвы воздействию тепла
и кислород, чтобы ослабить, но не убить их. - 1885 г. — Пастер разработал успешную вакцину
против бешенства. Пастер использовал тот же подход, что и для вакцины против сибирской язвы. - 1914 — Вакцина против коклюша или коклюша
развитый. - 1926 — Разработана вакцина против дифтерии.
- 1938 — Разработана вакцина против столбняка.

- 1948 — Коклюш, дифтерия и столбняк
вакцины объединяют и вводят как вакцину АКДС. - 1955 — Джонас Солк разрабатывает прорыв полиомиелита
вакцина на основе мертвого полиовируса. - 1963 — Разработана вакцина против кори.
- 1967 — Разработана вакцина против эпидемического паротита.
- 1969 — Разработана вакцина против краснухи.
- 1977- Вакцина против оспы больше не производится
рекомендуемые. Благодаря успеху вакцины болезнь считается
искоренено. - 1981 — Разработана вакцина против гепатита В.
- 1996 — Разработана вакцина против ветряной оспы.
- 1998-1999 — Разработана ротавирусная вакцина.
- 2000 — Разработана вакцина против гепатита А.
- 2000 г. — Вакцина против полиомиелита больше не рекомендуется.
Благодаря успеху вакцины болезнь больше не считается угрозой. - 2001 — Разработана пневмококковая вакцина.
Рекомендуемая вакцинация на 2020 г.
список следующий [JM1] :
- Дифтерия*.
- Столбняк*.
- Коклюш*.
- Корь**
- Свинка**
- Краснуха**
- Полиомиелит (ИПВ)
- Хиб
- Гепатит В
- Вирус папилломы человека (ВПЧ)
- Ветряная оспа
- Гепатит А
- Пневмококковая
- Грипп
- Ротавирус
- Менингококковая инфекция ACWY
- Менингококковая инфекция B
*Дано в комбинации как DTaP
** Дано в комбинации как MMR
Вакцина
Безопасность
Безопасность
меры предосторожности были разработаны и реализованы одновременно с разработкой
вакцина. Вакцины в Соединенных Штатах тщательно тестируются и проверяются
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) перед распространением среди населения [JM3].
Разработка вакцины в США
следует этому процессу:
- Исследования, открытия и доклинические исследования
выполнено . Каждая компания, желающая разработать вакцину и начать
Каждая компания, желающая разработать вакцину и начать
клинические испытания должны подать заявку на получение нового исследовательского препарата (IND)
в FDA. IND описывает вакцину, как она будет производиться и
тесты контроля качества для выпуска. - Клинические исследования и испытания
- Фаза 1 — Испытания небольшие,
с участием от 20 до 100 добровольцев и длятся несколько месяцев. Цель
испытания фазы 1 должны оценить базовую безопасность и выявить любые общие
реакции. - Фаза 2 — Испытания включают
несколько сотен участников. Это может длиться от нескольких месяцев до
два года[JM4] . Фаза
2 исследования оценивают безопасность и эффективность. Данные, полученные на этом этапе, информируют
состав вакцины и необходимое количество доз. - Фаза 3 — Испытания включают
несколько тысяч добровольцев. Иногда это может длиться годами. Этот
Иногда это может длиться годами. Этот
Этап окончательно определяет безопасность и эффективность вакцины.
считается вакциной безопасной и эффективной[JM5],
производитель подает заявку на получение лицензии на биопрепараты (BLA) и
заявка на завод-изготовитель в FDA. FDA рассматривает
информация о клинических испытаниях. Только после того, как FDA рассмотрит заявку,
осматривает производственный объект и определяет, что все безопасно
вакцина, лицензированная для использования среди населения в целом.
вакцины, Консультативный комитет по практике иммунизации (ACIP), который
состоит из группы экспертов в области медицины и общественного здравоохранения, разрабатывает
рекомендации по использованию вакцин для борьбы с болезнями в США
Состояния. Рекомендации ACIP направляются в CDC и Департамент США.


 Обязательно спросите о том, какие и когда реакции на прививку могут возникнуть и в каких случаях обращаться за медицинской помощью.
Обязательно спросите о том, какие и когда реакции на прививку могут возникнуть и в каких случаях обращаться за медицинской помощью.

 При появлении сильных реакций в месте укола (припухлость, уплотнение, покраснение) сделайте согревающий компресс или просто периодически прикладывайте смоченную водой ткань. Если противовоспалительные средства еще не принимаются, начните их давать.
При появлении сильных реакций в месте укола (припухлость, уплотнение, покраснение) сделайте согревающий компресс или просто периодически прикладывайте смоченную водой ткань. Если противовоспалительные средства еще не принимаются, начните их давать.
 Каждая компания, желающая разработать вакцину и начать
Каждая компания, желающая разработать вакцину и начать Иногда это может длиться годами. Этот
Иногда это может длиться годами. Этот