Содержание
Пермячка скончалась после прививки от коронавируса «Спутником V» февраль 2022 г | 59.ru
Все новости
Расстрелял троих и покончил с собой. Что известно о трагедии в Крымске? Показываем в одном видео
Установят мониторы, включат музыку (горки тоже будут). Мэр Перми рассказал, как пройдет Новый год на эспланаде
Путин встретится с семьями мобилизованных перед Днем матери: новости СВО за 24 ноября
Проиграл суд жене и начал ее преследовать: всё, что известно о стрелявшем мужчине в Крымске
В Перми на новых остановках у «Колизея» будут табло прибытия транспорта, освещение, Wi-Fi и USB-зарядки
Мужчина открыл стрельбу на улице в Крымске — четыре человека погибли. Онлайн
Мужчина устроил стрельбу в Крымске. Есть погибшие
В учебной части в Тюмени умер мобилизованный из Пермского края. У него остались двое сыновей
Центр Перми встал в 10-балльных пробках
Приют для животных «Дружок» в Осинском районе закроют по решению суда
Фотофакт: у ТЦ «Колизей» на перекрестке Куйбышева и Ленина делают автобусную остановку
«Это слишком сложные понятия для ребенка»: психолог — о том, как начальная военная подготовка в школах отразится на детях
Девочка с двумя напарниками: полиция ищет подростков, обокравших продавщицу в ТЦ. Видео
Видео
«Я не хотел разрушать семью»: как объяснил убийство молодой любовницы мужчина, регулярно изменявший жене
«Это борьба с дьяволом». Митрополиту Мефодию присвоили звание почетного гражданина Прикамья — он сказал речь про СВО
В Пермском крае запустили кредитную линию: льготные условия действуют для бизнеса
Парламентарии окончательно утвердили бюджет Пермского края
По двум маршрутам в Перми проедет экомобиль, который будет бесплатно принимать вторсырье
Алексей Демкин проинспектировал ремонт площади в районе Речного вокзала
«Думаю, мостик мог соскользнуть и оставить ссадины»: новые подробности истории с проводником из Перми, который поранился и умер
«Кадровик может быть поверхностным». HR — о том, в каких случаях на собеседовании лучше врать
Пермские ученые создали приложение, которое по фото может определять инсульт
Госдума приняла закон о запрете пропаганды ЛГБТ. Вот за что теперь будут наказывать
Пермяк, который несколько месяцев провел в плену на Украине, вернулся в Россию
Жители Прикамья проголосуют, как будет выглядеть «Новая Пермь»
В Перми на два дня перекроют движение по улице Барамзиной в районе старой водонапорной башни
Россиян заставят тратить больше денег. Конфискуют ли сбережения? Мнения экспертов
Конфискуют ли сбережения? Мнения экспертов
Успеть до 30 ноября: магазины парфюмерии и косметики устроили масштабную распродажу
Уполномоченным по правам человека в Прикамье стал бывший мэр Перми и депутат Госдумы Игорь Сапко
Пройти тест-драйв на кроссовере и получить призы пермяки смогут на Дне открытых дверей нового центра
Дадут по 100 тысяч на ребенка. В Прикамье появится новое пособие для родителей двоен
До конца года в Перми реализуют на торгах четыре участка под многоквартирное жильё
Заксобрание разрешило губернатору Прикамья занимать пост более двух сроков подряд
Чусовской и выксунский заводы подтвердили лидерство по промышленному туризму в России
Бизнес на военниках: сколько стоит отмазаться от армии и от мобилизации и законно ли это
Пропавшего в Перми 55-летнего мужчину нашли живым
А сколько это в рублях: советы, как сэкономить на электричестве
«Хозяйка проверяла, одна ли я сплю»: 11 кошмарных историй об аренде жилья и еще одна — она вернет веру в людей
Оформили кредитные каникулы и привезли дрова. В Минсоцразвития Прикамья рассказали, как помогают семьям мобилизованных
В Минсоцразвития Прикамья рассказали, как помогают семьям мобилизованных
Все новости
Женщина привилась первым компонентом вакцины в середине августа, а затем ее самочувствие начало ухудшаться
Фото: Тимофей Калмаков
Поделиться
42-летняя жительница Перми Татьяна (здесь и далее имена изменены по просьбе ее супруга) весной 2020 года переболела коронавирусом, а следующим летом сделала прививку первым компонентом «Спутника V». После вакцинации она начала чувствовать недомогание, температура тела повысилась до 39 градусов. В итоге женщину госпитализировали, через несколько дней после этого она скончалась. Муж Татьяны Сергей отправил официальную претензию в Минздрав, чтобы там разобрались в причинах случившегося.
Сергей рассказывает: в апреле 2020 года он и его жена переболели коронавирусом. Их госпитализировали в инфекционную больницу, но супруги переносили заболевание легко.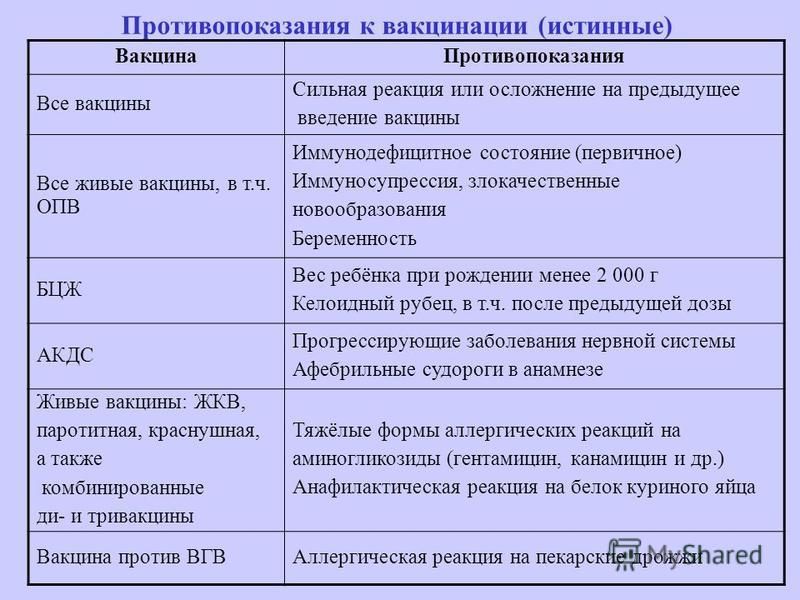
— Поражения легких у нее вообще не было, у меня было поражение в районе пяти процентов, — вспоминает Сергей. — Просто температура, небольшая одышка была. Мы в больнице отлежали две недели и до больницы — дня три.
В 2021 году для работы Татьяне требовалась прививка от коронавируса, к тому же, говорит Сергей, они планировали поездку на юг. Супруги вместе пришли в поликлинику, но в тот день у Татьяны было покраснение горла, поэтому вакцинацию пришлось отложить. Затем ее снова перенесли из-за недомогания, а 13 августа женщина сделала прививку первым компонентом «Спутника V» в поликлинике № 5 на Екатерининской, 224.
Первые дни после прививки первым компонентом у супругов была схожая реакция на препарат. У них, как и у многих, поднялась температура.
— Меня знобило, колотило. Дня два-три это было, потом прошло. Еще после первой прививки сильно болела рука. Вторую прививку я вообще не почувствовал, — рассказывает мужчина. — У жены также [после первого компонента] два дня температура поднималась. Ну, подумали: как у всех, не обратили внимания.
Ну, подумали: как у всех, не обратили внимания.
С 15 августа состояние Татьяны стало ухудшаться. Появились отеки на ногах, слабость, одышка, пропал аппетит, температура повысилась до 39 градусов и онемела область нижней челюсти. Супруги решили, что это может быть инсульт, поэтому вызвали скорую помощь, которая отвезла в больницу. Обследования не выявили каких-то нарушений в работе нервной системы, и Татьяна вернулась домой. С 25 августа женщине открыли больничный.
— Такое состояние непонятное было, [у нее] ломило в груди. Потом сделали КТ, оно показало жидкость в легких, пневмония. Ну пневмонии уже миллион лет, она лечится, как дважды два, — говорит Сергей. — Приехали домой, вызвали скорую, это было 5 сентября. Ее увезли в больницу, в «девятку» (ГКБ имени Тверье. — Прим. ред.) положили. В субботу ее не стало.
Женщину увезли в больницу имени Тверье
Фото: Тимофей Калмаков
Поделиться
Пациентка скончалась в отделении реанимации 11 сентября. Родные не понимают, из-за чего наступила смерть. По словам Сергея, в справке о смерти был указан один диагноз (рак груди и сердечная недостаточность), а в результате вскрытия — рак крови (хронический лейкоз с лейкемической инфильтрацией внутренних органов, по документу смерть наступила от прогрессирующей полиорганной недостаточности).
Родные не понимают, из-за чего наступила смерть. По словам Сергея, в справке о смерти был указан один диагноз (рак груди и сердечная недостаточность), а в результате вскрытия — рак крови (хронический лейкоз с лейкемической инфильтрацией внутренних органов, по документу смерть наступила от прогрессирующей полиорганной недостаточности).
Супруг объясняет, что для него диагноз, который уже после смерти поставили супруге, был неожиданным. Они не знали, что Татьяна больна.
— Причем она каждый год проходила диспансеризацию, потому что работала в серьезной организации, скажем так, — говорит муж. — Кровь постоянно сдавала, все анализы проходила. Нигде ничего не было.
Никаких противопоказаний, о которых бы знали супруги, для прививки у Татьяны не было. Сергей отмечает, что если бы они знали о болезни, то обратились бы к врачу.
Недавно Сергей вместе с юристом написал официальную претензию в Минздрав и в страховую компанию, документ есть в распоряжении редакции. В нём супруг просит провести проверку контроля качества и безопасности медицинской деятельности по факту оказания медпомощи Татьяне и привлечь к ответственности виновных.
В нём супруг просит провести проверку контроля качества и безопасности медицинской деятельности по факту оказания медпомощи Татьяне и привлечь к ответственности виновных.
— Может, кто-то виноват [в этом]. Но я не утверждаю, что это произошло именно так, может, стечение обстоятельств… Если виноват, то будем обращаться в суд. [Хотим узнать,] как это могло произойти, и сделать так, чтобы больше не происходило, — объясняет Сергей. — Может, мы этим спасем несколько жизней, мы вот про что думаем в первую очередь. И почему до сих пор никто на это не обращает внимание? На то, что люди после прививок умирают. Если такое происходит, [хотим,] чтобы обратили.
Если по итогам проверки супруг решит обращаться в суд, то будет требовать компенсацию морального вреда.
Редакция 59.RU обратилась в краевой Минздрав, чтобы в ведомстве прокомментировали ситуацию. В министерстве от комментариев отказались, ссылаясь на врачебную тайну, и рекомендовали родственникам отправить официальную жалобу в Минздрав, для того чтобы провести ведомственную проверку (к моменту отправки запроса родственники уже это сделали).
Мы попросили прокомментировать ситуацию бывшего заведующего отделением Национального медицинского исследовательского центра онкологии имени Н.Н. Блохина Георгия Менткевича.
— Обычно по моей практике, чтобы комментировать то, что вы рассказали, мне нужен полный документ истории болезни. На самом деле ситуация выглядит очень похожей на криминальную. Не со стороны грубого нарушения. От любой прививки, я подчеркиваю — от любой, в небольшом проценте случаев могут быть побочные эффекты, а в некоторых случаях часть [поставивших прививку] может умереть, это описано. Все остальное [описанное в истории] — это на самом деле темы для серьезной врачебной комиссии. По крайней мере, на моей памяти было много случаев, когда дело передавалось следственным органам, — говорит онколог. — Потому что не бывает так, что рак молочной железы трансформировался в лейкоз — и больному сделали прививку. Вообще, на самом деле плохо, что сделали прививку, если у человека был лейкоз, вместо того чтобы лечить его от лейкоза. Тем более молодая женщина. Понимаете, она поступает в клинику, ей не могут поставить диагноз «лейкоз», это смешно! Анализ крови уж наверняка у нее брали. Поэтому здесь информации не хватает, должна быть, с моей точки зрения, серьезная проработка этого случая, так же как и многих других случаев гибели пациентов от COVID, не от COVID. <…> Конкретно высказаться, какой диагноз и что послужило причиной смерти, абсолютно невозможно.
Тем более молодая женщина. Понимаете, она поступает в клинику, ей не могут поставить диагноз «лейкоз», это смешно! Анализ крови уж наверняка у нее брали. Поэтому здесь информации не хватает, должна быть, с моей точки зрения, серьезная проработка этого случая, так же как и многих других случаев гибели пациентов от COVID, не от COVID. <…> Конкретно высказаться, какой диагноз и что послужило причиной смерти, абсолютно невозможно.
Специалист отмечает: будет ли онкология противопоказанием к прививке, зависит от ее типа и фазы. Во время ремиссии пациентов прививают. А в периоды, когда человек получает терапию, его способность к иммунному ответу сильно ослаблена, и в этот период вакцинацию не проводят.
Ранее мы рассказывали о другом трагическом случае, связанном с коронавирусом. 34-летний Виктор Островский в середине ноября заболел коронавирусом. У него несколько дней держалась высокая температура, но после он начал чувствовать себя лучше. В день улучшения он выпил лекарство от коронавируса, которое принес врач, и через несколько часов внезапно упал без сознания. Виктор умер до приезда реанимации. Его жена Анна считает, что мужа лечили неправильно, она обратилась в прокуратуру. После случившегося проверку организовал Следственный комитет. Мы вместе с экспертом разбирались, могли ли причиной смерти стать препараты.
Виктор умер до приезда реанимации. Его жена Анна считает, что мужа лечили неправильно, она обратилась в прокуратуру. После случившегося проверку организовал Следственный комитет. Мы вместе с экспертом разбирались, могли ли причиной смерти стать препараты.
По теме
20 февраля 2022, 14:59
За сутки от коронавируса скончались 25 жителей Прикамья
15 февраля 2022, 13:42
Небольшое снижение: в Прикамье за сутки выявили 5 199 новых зараженных коронавирусом
10 февраля 2022, 15:21
Беременная двойней из Соликамска винит врачей, что они пропустили у нее пневмонию. Из-за поражения легких ее отправили на кесарево
09 декабря 2021, 13:42
Следователи начали проверку по факту внезапной смерти пермяка после приема лекарства от коронавируса
26 ноября 2021, 15:59
Пермяк внезапно умер после приема лекарства от коронавируса. Его жена пожаловалась на неправильное лечение
Мария Квашнина
корреспондент раздела «Город»
МинздравКоронавирус в ПермиОнкологияПрививка от коронавируса
- ЛАЙК8
- СМЕХ3
- УДИВЛЕНИЕ2
- ГНЕВ41
- ПЕЧАЛЬ25
Увидели опечатку? Выделите фрагмент и нажмите Ctrl+Enter
КОММЕНТАРИИ198
Читать все комментарии
Что я смогу, если авторизуюсь?
ПРАВИЛА КОММЕНТИРОВАНИЯ
0 / 1400
Этот сайт защищен reCAPTCHA и Google. Применяются Политика конфиденциальности и Условия использования.
Применяются Политика конфиденциальности и Условия использования.
Новости СМИ2
Новости СМИ2
Вакцина против лейкемии кошек felv
Вакцина против лейкоза кошек
Вакцинация против вирусной лейкемии кошек
Когда проводят вакцинацию кошкам от лейкемии
Осложнения после прививки от лейкоза
Вирусная лейкемия кошек (лейкоз кошек, Feline Leukemia Virus или FeLV) — распространенное инфекционное заболевание кошек, вызываемое РНК-содержащим ретровирусом. Патологический процесс связан с возникновением и последующим злокачественным разрастанием кроветворной ткани. При этом образуются новые клеточные формы, замещающие и мешающие созреванию здоровых клеток крови. Заболевание распространено во всем мире, в группе риска кошки, живущие в скученных условиях — в приютах и питомниках, все кошки на самовыгуле (включая дачный). В некоторых случаях кошки могут самостоятельно бороться с этим вирусом (элиминировать), также устойчивость повышается с возрастом, однако при повторном контакте с носителями лейкоза вполне вероятна передача заболевания. При проявлении клинических признаков прогноз неблагоприятный, практически всегда летальный исход. На ранних стадиях (от нескольких недель до нескольких лет) болезнь может протекать скрыто, без клинических симптомов, с чем точно связана активация вируса, пока точно неизвестно, но известно, что роль играют стрессы, неблагоприятные условия, изменение условий содержания и кормления.
При проявлении клинических признаков прогноз неблагоприятный, практически всегда летальный исход. На ранних стадиях (от нескольких недель до нескольких лет) болезнь может протекать скрыто, без клинических симптомов, с чем точно связана активация вируса, пока точно неизвестно, но известно, что роль играют стрессы, неблагоприятные условия, изменение условий содержания и кормления.
Существует несколько разных типов вакцин против вирусной лейкемии кошек. В России чаще всего применяется только вирусная рекомбинантная вакцина (производитель Purevax, торговая марка Purevax FeLV). Вакцина против вирусной лейкемии кошек не относится к основным, согласно рекомендациям WSAVA, однако ее необходимо рекомендовать для всех кошек, которые находятся в группе риска и могут иметь контакты с инфицированными животными. Чаще всего заражаются кошки, которые могут свободно гулять по улице, однако даже жительство с бывшей уличной кошкой несет риск заражения. Поэтому если у Вас бывают кошки, которые могут оказаться носителями вируса, своих домашних любимцев рекомендуется вакцинировать.
В приютах и питомниках обязательно очень внимательное отношение к профилактике заражения, в частотности, лейкоз передается котятам от зараженных родителей.
Вакцинировать кошек, уже являющихся носителями вируса FeLV, нельзя. Поэтому перед вакцинацией обязательно проведение серологического тестирования на наличие антител к вирусу лейкоза. Гарантировать, что кошка не является носителем, можно только в относительно редких случаях — например, котята от родителей с отрицательными результатами тестирования, которые не имели контактов с другими животными, тоже будут иметь отрицательный FeLV-статус. В нашей клинике в Москве проведение тестирование осуществляется при помощи экспресс-тестов, поэтому его можно провести сразу в день предполагаемой вакцинации, он не занимает много времени.
Первую вакцинацию, для кошек группы риска, особенно в приютах, можно рекомендовать проводить вакцинацию котятам уже в возрасте 8 недель, с обязательной ревакцинацией через 2-4 недели.
Первичная вакцинация от лейкоза всегда проводится двукратно с интервалом не более чем 4 недели. Если после первой прививки пройдет 5-6 недель — нужно будет снова сделать вакцинацию, и провести ревакцинацию через 2-4 недели, иначе не сформируется достаточно напряженный иммунитет. Это же правило относится и к взрослым животным — первая вакцинация всегда двукратная. Далее можно ревакцинировать ежегодно. Существует информация о том, что с возрастом кошки становятся более устойчивыми к инфекции, и после 3 лет их можно ревакцинировать от FeLV раз в 3 года. Однако клинически достоверный иммунитет при вакцинации имеющейся в России вакциной Пуревакс FeLV был определен длительностью в 12-14 месяцев, поэтому мы рекомендуем ежегодную ревакцинацию. Повторные ревакцинации (кроме первой) проводятся однократно.
Однократная первичная вакцинация от лейкоза кошек не будет являться защитой от заболевания.
Прививка проводится только клинически здоровым животным. Перед вакцинацией кошку обязательно осматривает врач, проводит (при первой вакцинации) серологическое тестирование. Еще раз повторим, что для кошек, уже являющихся носителями вируса, вакцинация от лейкоза бесполезна (в некоторых случаях может оказаться вредна).
Еще раз повторим, что для кошек, уже являющихся носителями вируса, вакцинация от лейкоза бесполезна (в некоторых случаях может оказаться вредна).
Вакцина вводится подкожно.
Видео вакцинации кошки от лейкоза:
Для кошек осложнения после вакцинации могут проявляться в виде небольшого уплотнения на месте введения вакцины — оно не представляет опасности и через некоторое время самостоятельно исчезнет. В редких случаях вакцина может вызвать проявление индивидуальной непереносимости (аллергическую реакцию), которая лечится симптоматически. Такая реакция обычно проявляется сразу после попадания аллергена в организм, поэтому врач в клинике может оперативно принять меры. Еще одно осложнение, характерное для кошек — постинъекционная саркома, которая, к сожалению, может развиться на месте любого укола. Это — редкое осложнение (по разным данным, одно животное из 6-12 тысяч), тем не менее, есть рекомендации о проведении вакцинаций не в область холки, а в дистальные отделы конечностей или хвоста. Также рекомендуется ежегодно менять места проведения инъекций при прививках. Можно оставлять информацию о локализации в паспорте, чтобы при ревакцинации через год не возникало вопросов, куда прививали кошку.
Также рекомендуется ежегодно менять места проведения инъекций при прививках. Можно оставлять информацию о локализации в паспорте, чтобы при ревакцинации через год не возникало вопросов, куда прививали кошку.
(с) Ветеринарный центр лечения и реабилитации животных «Зоостатус».
Варшавское шоссе, 125 стр.1. тел. 8 (499) 372-27-37
Категория wiki
Поведение
Почитайте отзывы о нашем ветеринарном центре.
Позвоните по номеру 8 (495) 241 64 95 и запишитесь на консультацию прямо сейчас.
(с) Ветеринарный центр лечения и реабилитации животных «Зooстатус».
Варшавское шоссе, 125 стр.1.
Случай хронического миеломоноцитарного лейкоза, раскрытый после получения вакцины J&J против COVID-19
Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19
Синдхуша Веерабалли, Адитья Патель, Гоутами Аре, Амр Рамахи, Сахити Читтамури, Хамид Шаабан
- Статья
- Авторы и т.
 д.
д.
- Метрики
- Цифры и т.д.
Синдхуша Веерабалли , Адитья Патель, Гаутами Аре, Амр Рамахи, Сахити Читтамури, Хамид Шаабан
Опубликовано:
18 июня 2022 г.
(см. историю)
DOI:
10.7759/куреус.26070
Цитируйте эту статью как:
Веерабалли С., Патель А., Аре Г. и др. (18 июня 2022 г.) Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19. Куреус 14(6): e26070. Дои: 10.7759/cureus.26070
Abstract
Хронический миеломоноцитарный лейкоз (ХММЛ) — клональное заболевание гемопоэтических стволовых клеток, протекающее под перекрестным синдромом (миелодиспластические и миелопролиферативные заболевания). ХММЛ характеризуется моноцитозом периферической крови и дисплазией костного мозга. Патогенез ХММЛ изучен недостаточно. Хотя цитогенетические и молекулярные аномалии встречаются часто, они не являются диагностическими. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцина с редкой ассоциацией ограниченной склеродермии. На основании обзора статистики рака, эпидемиологии и конечных результатов (SEER) за 2014-2018 гг., пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000) по сравнению с женщинам (0,3/100 000). Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина. Наш случай предполагает возможность развития CMML после получения вакцины J&J COVID. Иммунизация всегда была мерой по спасению жизней в истории. Поскольку мир предвидит получение вакцины от COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцина с редкой ассоциацией ограниченной склеродермии. На основании обзора статистики рака, эпидемиологии и конечных результатов (SEER) за 2014-2018 гг., пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000) по сравнению с женщинам (0,3/100 000). Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина. Наш случай предполагает возможность развития CMML после получения вакцины J&J COVID. Иммунизация всегда была мерой по спасению жизней в истории. Поскольку мир предвидит получение вакцины от COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Введение
Перекрывающиеся синдромы миелодиспластического синдрома (МДС)/миелопролиферативного новообразования (МПН) представляют собой уникальные миелоидные новообразования с перекрывающимися признаками МДС и МПН. Они состоят из четырех нозий взрослых: хронический миеломоноцитарный лейкоз (CMML), MDS/MPN кольцевые сидеробласты-тромбоцитоз, BCR-ABL-1-отрицательный атипичный хронический миелоидный лейкоз (aCML) и MDS/MPN-неклассифицируемый; и одно педиатрическое заболевание, представляющее собой ювенильный миеломоноцитарный лейкоз [1]. ХММЛ характеризуется моноцитозом периферической крови и дисплазией костного мозга. Это обычно встречается у пожилых людей со средним возрастом при постановке диагноза от 65 до 75 лет и соотношением мужчин и женщин 1,5–3,1: 1 [2,3]. Клинические признаки ХММЛ неспецифичны; они связаны либо с миелопролиферативными симптомами, либо с симптомами, связанными с цитопениями. Патогенез ХММЛ изучен недостаточно. Хотя цитогенетические и молекулярные аномалии распространены, они не являются диагностическими [3,4]. Примерно у 20% пациентов имеются сопутствующие системные воспалительные и аутоиммунные заболевания (SIAD) [5-8]. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцины в сочетании с ограниченной склеродермией.
Примерно у 20% пациентов имеются сопутствующие системные воспалительные и аутоиммунные заболевания (SIAD) [5-8]. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцины в сочетании с ограниченной склеродермией.
Описание случая
74-летняя женщина с астмой, гипертензией и дислипидемией в анамнезе поступила в отделение неотложной помощи с жалобами на одышку и общую слабость в течение двух дней. Пациент сообщает, что симптомы начались после получения первой дозы вакцины Джонсона и Джонсона от COVID-19. Она была гемодинамически стабильной с частотой сердечных сокращений 94, частотой дыхания 21 и скоростью сатурации 9.9% на комнатном воздухе. Физикальное обследование в целом ничем не примечательно, за исключением уменьшения поступления воздуха с легкими диффузными хрипами с обеих сторон при аускультации легких. Цианоза и отека конечностей нет. Общий анализ крови показал гемоглобин 9,9 г/дл (норма: 12–15,5 г/дл), тромбоциты 37 × 10 3 /мкл (норма: 150–450 × 10 3 /мкл), лейкоциты количество 19,4 × 10 3 /мкл (норма: 4,4-11 × 10 3 /мкл) с дифференциалами, показывающими моноциты 11,5 x 10 3 /мкл (норма: 0,3 — 0,9 × 10 3 /мкл), лимфоциты 3,8 x 10 3 /мкл (норма: 0,9–2,9 x 10 3 /мкл), нейтрофилы 3,9 × 10 4 / 3 мкл (норма: 1,7–7 × 10 3 /мкл) и эозинофилы 0,1 × 10 3 /мкл (норма: 0–0,5 × 10 3 /мкл). Сравнение общего анализа крови до введения вакцины против COVID-19 и после введения вакцины против COVID-19 включено в Таблицу 1 .
Сравнение общего анализа крови до введения вакцины против COVID-19 и после введения вакцины против COVID-19 включено в Таблицу 1 .
| До COVID до прививки (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
Стол
1: Сравнение общего анализа крови до и после введения вакцины против COVID-19.

Анализы на гепатит и вирус иммунодефицита человека дали отрицательный результат. Тромбоцитопения была связана с вакцинозависимой иммунной тромбоцитопенической пурпурой (ИТП). Пациент получил снижающуюся дозу стероидов и две дозы внутривенного иммуноглобулина (1 г/кг) в качестве лечения ИТП, при этом наблюдалось лишь временное повышение уровня тромбоцитов. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Она также начала жаловаться на сухость во рту, затрудненное глотание и новые эпизоды побеления пальцев при низких температурах. Ревматологический анализ дал положительный результат на антицентромерные антитела и антитела Сойгрена к SSA. C-ANCA, P-ANCA, RF, анти-SSB и анти-склеродермия 70 были отрицательными. Криоглобулин, холодовые агглютинины и прямой тест также были отрицательными.
При последующем наблюдении было замечено, что у пациента прогрессирует тяжелая анемия и лейкоцитоз с постоянно высокими и повышающимися моноцитами. Проточная цитометрия биоптатов периферической крови и костного мозга проводилась для исключения лейкемии. Результаты биопсии костного мозга были значимыми для хронического миеломоноцитарного лейкоза стадии 0 (ХММЛ-0) в гиперцеллюлярном костном мозге. Бласты и промоноциты не увеличены; в условиях тяжелой анемии и тромбоцитопении с моноцитозом (AMC 12,6 K/мкл — 53,8% от общего числа лейкоцитов) соответствовал CMML 0. Секвенирование следующего поколения выявило вариации генов KRAS, NPM1 и TET2, а кариотипирование показало 46, XX женщин кариотипы. Проточная цитометрия показала моноцитоз (60%) и дисгранулопоэз без увеличения количества бластов или лимфопролиферативных нарушений. Количество CD34-позитивных миелобластов не увеличивается, и они составляют 0,4% от общего числа клеток. Количество моноцитов (60%) увеличено со снижением CD13 и CD14 и повышением уровня HLA-DR, что свидетельствует о смещении созревания влево. гранулоциты (19%) демонстрируют снижение бокового рассеяния, что свидетельствует о гипогранулярности со смещенным влево характером созревания CD13/CD16 и аберрантной коэкспрессией CD56, что свидетельствует о дисгранулопоэзе.
Результаты биопсии костного мозга были значимыми для хронического миеломоноцитарного лейкоза стадии 0 (ХММЛ-0) в гиперцеллюлярном костном мозге. Бласты и промоноциты не увеличены; в условиях тяжелой анемии и тромбоцитопении с моноцитозом (AMC 12,6 K/мкл — 53,8% от общего числа лейкоцитов) соответствовал CMML 0. Секвенирование следующего поколения выявило вариации генов KRAS, NPM1 и TET2, а кариотипирование показало 46, XX женщин кариотипы. Проточная цитометрия показала моноцитоз (60%) и дисгранулопоэз без увеличения количества бластов или лимфопролиферативных нарушений. Количество CD34-позитивных миелобластов не увеличивается, и они составляют 0,4% от общего числа клеток. Количество моноцитов (60%) увеличено со снижением CD13 и CD14 и повышением уровня HLA-DR, что свидетельствует о смещении созревания влево. гранулоциты (19%) демонстрируют снижение бокового рассеяния, что свидетельствует о гипогранулярности со смещенным влево характером созревания CD13/CD16 и аберрантной коэкспрессией CD56, что свидетельствует о дисгранулопоэзе. В-клетки (1,7%) являются политипными, а Т-клетки (8,2%) показывают нормальное соотношение CD4:CD8 без делеции пан-Т-клеточного антигена. Жизнеспособность составляет 91,13%. Панель ОМЛ в цитогенетическом исследовании FISH была отрицательной для RUNX1T1/RUNX1 (ETO/AML1), KMT2A (MLL), PML/RARA, реаранжировки CBFB, отрицательной для моносомии 5 и делеции CSF1R/RPS14 на длинном плече хромосомы 5. на q33, отрицательный на моносомию 7 и делецию MDFIC на длинном плече хромосомы 7 на q31. Панель MPN / CML также была отрицательной для перестройки BCR / ABL1, трисомии 8, 9., и делеция DLEU1, DLEU2 на длинном плече хромосомы 13 в q14 и делеция PTPRT на длинном плече хромосомы 20 в q12. Стратификация риска на основе молекулярной модели Мэйо классифицировала ее как группу высокого риска с оценкой 3 балла и среднюю степень риска с помощью модели GFM. Основываясь на функциональном состоянии и физической подготовке, пациентку отнесли к группе среднего риска, но она зависела от инфузии, поскольку она получила несколько трансфузий тромбоцитов и pRBC.
В-клетки (1,7%) являются политипными, а Т-клетки (8,2%) показывают нормальное соотношение CD4:CD8 без делеции пан-Т-клеточного антигена. Жизнеспособность составляет 91,13%. Панель ОМЛ в цитогенетическом исследовании FISH была отрицательной для RUNX1T1/RUNX1 (ETO/AML1), KMT2A (MLL), PML/RARA, реаранжировки CBFB, отрицательной для моносомии 5 и делеции CSF1R/RPS14 на длинном плече хромосомы 5. на q33, отрицательный на моносомию 7 и делецию MDFIC на длинном плече хромосомы 7 на q31. Панель MPN / CML также была отрицательной для перестройки BCR / ABL1, трисомии 8, 9., и делеция DLEU1, DLEU2 на длинном плече хромосомы 13 в q14 и делеция PTPRT на длинном плече хромосомы 20 в q12. Стратификация риска на основе молекулярной модели Мэйо классифицировала ее как группу высокого риска с оценкой 3 балла и среднюю степень риска с помощью модели GFM. Основываясь на функциональном состоянии и физической подготовке, пациентку отнесли к группе среднего риска, но она зависела от инфузии, поскольку она получила несколько трансфузий тромбоцитов и pRBC. В результате пациентке была начата терапия азацитидином, которая значительно улучшила количество клеток после двух циклов. Однако при дальнейшем наблюдении было обнаружено, что у нее развился ОМЛ, и она умерла из-за острой дыхательной недостаточности, вторичной по отношению к COVID-19.пневмония.
В результате пациентке была начата терапия азацитидином, которая значительно улучшила количество клеток после двух циклов. Однако при дальнейшем наблюдении было обнаружено, что у нее развился ОМЛ, и она умерла из-за острой дыхательной недостаточности, вторичной по отношению к COVID-19.пневмония.
Обсуждение
ХММЛ — редкое и агрессивное клональное новообразование гемопоэтических стволовых клеток, характеризующееся моноцитозом (≥10% количества лейкоцитов) [1]. Перекрывающиеся клинические, лабораторные и морфологические признаки миелодисплазии и миелопролиферации сделали ХММЛ подгруппой МДС/МПН в классификации опухолей кроветворной и лимфоидной тканей Всемирной организации здравоохранения (ВОЗ) [1]. На основании обзора статистики рака за 2014–2018 годы, проведенного в рамках обзора эпиднадзора, эпидемиологии и конечных результатов (SEER), пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000). по сравнению с женщинами (0,3/100 000). [2]. Диагностические критерии ХММЛ согласно рекомендациям ВОЗ включают стойкий моноцитоз периферической крови (≥1 × 10 9/л) с моноцитами, составляющими ≥10% количества лейкоцитов (лейкоцитов) в течение как минимум трех месяцев при исключении всех других причин моноцитоза и наличии <20% бластов в крови и костном мозге. Заболевания, которые следует исключить, включают лейкемию BCR-ABL1+, классическую МПН, острый миелоидный лейкоз и другие гематологические злокачественные новообразования [3]. Наличие мутаций, связанных с CMML, таких как TET2, SRSF2, SETBP1, ASXL1, подтверждает диагноз CMML. Кроме того, CMML подразделяется на CMML-0, CMML-1 и CMML-2 на основе бластных клеток ВОЗ, а также на миелодиспластический вариант и миелопролиферативный вариант на основе количества лейкоцитов Франко-американо-британским (FAB) кооперативом. Группа лейкозов [3,4]. Наш пациент с 3% бластных клеток в костном мозге относится к подгруппе CMML-0. Единственным вариантом лечения, модифицирующим заболевание, является аллогенная трансплантация стволовых клеток.
по сравнению с женщинами (0,3/100 000). [2]. Диагностические критерии ХММЛ согласно рекомендациям ВОЗ включают стойкий моноцитоз периферической крови (≥1 × 10 9/л) с моноцитами, составляющими ≥10% количества лейкоцитов (лейкоцитов) в течение как минимум трех месяцев при исключении всех других причин моноцитоза и наличии <20% бластов в крови и костном мозге. Заболевания, которые следует исключить, включают лейкемию BCR-ABL1+, классическую МПН, острый миелоидный лейкоз и другие гематологические злокачественные новообразования [3]. Наличие мутаций, связанных с CMML, таких как TET2, SRSF2, SETBP1, ASXL1, подтверждает диагноз CMML. Кроме того, CMML подразделяется на CMML-0, CMML-1 и CMML-2 на основе бластных клеток ВОЗ, а также на миелодиспластический вариант и миелопролиферативный вариант на основе количества лейкоцитов Франко-американо-британским (FAB) кооперативом. Группа лейкозов [3,4]. Наш пациент с 3% бластных клеток в костном мозге относится к подгруппе CMML-0. Единственным вариантом лечения, модифицирующим заболевание, является аллогенная трансплантация стволовых клеток. Но большинство пациентов остаются неподходящими, учитывая возраст начала заболевания и сопутствующие заболевания. Текущий терапевтический выбор зависит от симптомов, вызванных цитопенией или связанных с пролиферацией, которые включают стимулирующие эритропоэз агенты, циторедуктивные агенты и гипометилирующие агенты [9].,10]. В настоящее время проводится несколько клинических испытаний новых терапевтических возможностей для ХММЛ. Гипометилирующие агенты, такие как азацитидин, децитабин и пероральный децитабин/цедазуридин, были одобрены FDA США для лечения CMML [9,10].
Но большинство пациентов остаются неподходящими, учитывая возраст начала заболевания и сопутствующие заболевания. Текущий терапевтический выбор зависит от симптомов, вызванных цитопенией или связанных с пролиферацией, которые включают стимулирующие эритропоэз агенты, циторедуктивные агенты и гипометилирующие агенты [9].,10]. В настоящее время проводится несколько клинических испытаний новых терапевтических возможностей для ХММЛ. Гипометилирующие агенты, такие как азацитидин, децитабин и пероральный децитабин/цедазуридин, были одобрены FDA США для лечения CMML [9,10].
Более высокая распространенность SIAD была признана у пациентов с CMML по сравнению с населением в целом. Подсчитано, что 20% случаев ХММЛ связаны с SIAD [5]. В исследовании, проведенном Peker et al. из 123 пациентов с ХММЛ у 24 были выявлены аутоиммунные и воспалительные заболевания (АИЗ), из которых наиболее часто встречалась ИТП, затем следовали подагра, псориаз, рассеянный склероз, синдром Шегрена, ВЗК, аутоиммунная анемия и ревматическая полимиалгия, тогда как у четырех пациенты [6] имели более одного АИЗ. В другом исследовании, проведенном Zahid et al. [7] у 377 пациентов с ХММЛ у 77 пациентов (20%) был ассоциированный AID/SIS. Это исследование выявило гетерогенность СПИДа/SIS, связанного с CMML, причем наиболее распространенными являются неопределенные воспалительные синдромы, за которыми следуют ревматоидный артрит, псориаз, иммуноопосредованная тромбоцитопения, ревматическая полимиалгия и системный васкулит. У нашего пациента склеродермия с повышенным уровнем антител к центромере 2b и симптомами затрудненного глотания и феномена Рейно. У нее также синдром Шегрена с повышенным уровнем анти-SSA и сухостью во рту. Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина.
В другом исследовании, проведенном Zahid et al. [7] у 377 пациентов с ХММЛ у 77 пациентов (20%) был ассоциированный AID/SIS. Это исследование выявило гетерогенность СПИДа/SIS, связанного с CMML, причем наиболее распространенными являются неопределенные воспалительные синдромы, за которыми следуют ревматоидный артрит, псориаз, иммуноопосредованная тромбоцитопения, ревматическая полимиалгия и системный васкулит. У нашего пациента склеродермия с повышенным уровнем антител к центромере 2b и симптомами затрудненного глотания и феномена Рейно. У нее также синдром Шегрена с повышенным уровнем анти-SSA и сухостью во рту. Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина.
Однако точный патогенез этой ассоциации еще предстоит определить. В системном обзоре, проведенном Ambinder et al. [5] обсуждалось множество убедительных биологических теорий патогенеза СПИДа при CMML, в том числе: (1) хроническое воспаление при аутоиммунных заболеваниях как триггер для CMML; (2) цитотоксические/иммуносупрессивные агенты, используемые при СПИДе как предрасполагающие факторы ХММЛ; (3) СПИД как следствие реакции иммунной системы на CMML 4. Клональные миелоидные элементы запускают СПИД. На основании имеющихся совокупных данных Ambinder et al. поддерживают гипотезу о том, что «SIAID являются следствием CMML». Несколько убедительных механизмов для вышеуказанной гипотезы включают аномальное поведение моноцитов и передачу сигналов, очевидную в клональном кроветворении, вызывающую избыточную экспрессию CD40 L, приводящую к системной красной волчанке (СКВ), избыточную экспрессию ICAM-1 и Ig-подобный лектин 1, связывающий сиаловую кислоту (Siglec-1), которые облегчают миграцию моноцитов в периферические ткани, что в конечном итоге приводит к увеличению экспрессии MHC-II и других костимулирующих молекул.
[5] обсуждалось множество убедительных биологических теорий патогенеза СПИДа при CMML, в том числе: (1) хроническое воспаление при аутоиммунных заболеваниях как триггер для CMML; (2) цитотоксические/иммуносупрессивные агенты, используемые при СПИДе как предрасполагающие факторы ХММЛ; (3) СПИД как следствие реакции иммунной системы на CMML 4. Клональные миелоидные элементы запускают СПИД. На основании имеющихся совокупных данных Ambinder et al. поддерживают гипотезу о том, что «SIAID являются следствием CMML». Несколько убедительных механизмов для вышеуказанной гипотезы включают аномальное поведение моноцитов и передачу сигналов, очевидную в клональном кроветворении, вызывающую избыточную экспрессию CD40 L, приводящую к системной красной волчанке (СКВ), избыточную экспрессию ICAM-1 и Ig-подобный лектин 1, связывающий сиаловую кислоту (Siglec-1), которые облегчают миграцию моноцитов в периферические ткани, что в конечном итоге приводит к увеличению экспрессии MHC-II и других костимулирующих молекул. апоптотические тельца увеличивают воздействие на организм аутоантигенов.Генетические аберрации в клональных миелоидных клетках могут вызывать SIAID, и это может объяснить симптомы SIAD до клинической картины CMML [5].Захид и др. обнаружили, что существует нет существенной разницы в общей выживаемости между пациентами с СПИДом и пациентами без СПИДа [7].С другой стороны, Montoro и др. сообщили p или общая выживаемость среди пациентов с сопутствующим МДС/ХММЛ и СИАИЗ [8].
апоптотические тельца увеличивают воздействие на организм аутоантигенов.Генетические аберрации в клональных миелоидных клетках могут вызывать SIAID, и это может объяснить симптомы SIAD до клинической картины CMML [5].Захид и др. обнаружили, что существует нет существенной разницы в общей выживаемости между пациентами с СПИДом и пациентами без СПИДа [7].С другой стороны, Montoro и др. сообщили p или общая выживаемость среди пациентов с сопутствующим МДС/ХММЛ и СИАИЗ [8].
В истории иммунизация всегда была средством спасения жизней. Он уже спас человечество от нескольких смертельных эпидемий и пандемий. Поскольку мир предвидит важность вакцины против COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. У нашей пациентки был нормальный общий анализ крови на исходном уровне, о чем свидетельствует анализ крови, полученный за шесть месяцев до того, как она получила вакцину против COVID-19. У нее были анемия, тромбоцитопения и лейкоцитоз через четыре дня после COVID-19. вакцина. При дальнейшем наблюдении тромбоциты продолжали снижаться, даже при резистентности к стероидам. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Постоянно повышенные моноциты повышали вероятность ХММЛ, что было подтверждено после исключения всех других возможных причин моноцитоза. Мы подозреваем, что вакцина против COVID-19 вызвала и разоблачила как ХММЛ, так и ассоциированную склеродермию у нашего пациента, учитывая острое начало и отсутствие других известных провоцирующих факторов.
вакцина. При дальнейшем наблюдении тромбоциты продолжали снижаться, даже при резистентности к стероидам. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Постоянно повышенные моноциты повышали вероятность ХММЛ, что было подтверждено после исключения всех других возможных причин моноцитоза. Мы подозреваем, что вакцина против COVID-19 вызвала и разоблачила как ХММЛ, так и ассоциированную склеродермию у нашего пациента, учитывая острое начало и отсутствие других известных провоцирующих факторов.
Выводы
В настоящее время важность вакцины против COVID-19 неоспорима. Однако сообщение о возможных нежелательных явлениях помогает нам понять связанные с этим риски. Наш случай предполагает возможность развития CMML, связанного с ограниченной склеродермией, после получения вакцины J&J COVID. Однако необходимо провести дальнейшие исследования, чтобы подтвердить гипотезу и узнать патогенез ассоциации. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Ссылки
- Арбер Д.А., Орази А., Хассерджян Р. и др.: Пересмотр 2016 г. классификации Всемирной организации здравоохранения миелоидных новообразований и острого лейкоза. Кровь. 2016, 127:2391-405. 10.1182/blood-2016-03-643544
- Обзор статистики рака SEER, CMML-2014-2018. (2019). Доступ: 4 апреля 2022 г.: https://seer.cancer.gov/statistics-network/explorer/application.html.
- Valent P, Orazi A, Savona MR, et al.: Предлагаемые диагностические критерии для классического хронического миеломоноцитарного лейкоза (CMML), вариантов CMML и состояний, предшествующих CMML. Гематология. 2019, 104:1935-49. 10.3324/haematol.2019.222059
- Patnaik MM, Tefferi A: Хронический миеломоноцитарный лейкоз: обновленная информация 2020 г. по диагностике, стратификации риска и лечению. Am J Гематол. 2020, 95:97-115. 10.1002/ajh.25684
- Амбиндер А.Дж., Миллер Дж., ДеЗерн А.Е.: Аутоиммунное заболевание при ХММЛ – курица или яйцо?. Best Pract Res Clin Haematol.
 2020, 33:101136. 10.1016/j.beha.2019.101136
2020, 33:101136. 10.1016/j.beha.2019.101136 - Peker D, Padron E, Bennett JM, et al.: Тесная связь аутоиммунных процессов и аутоиммунных заболеваний с хроническим миеломоноцитарным лейкозом: наблюдение из одного учреждения. Акта Гематол. 2015, 133:249-56. 10.1159/000365877
- Захид М.Ф., Баррако Д., Лашо Т.Л. и др.: Спектр аутоиммунных заболеваний и системных воспалительных синдромов у пациентов с хроническим миеломоноцитарным лейкозом. Лейк-лимфома. 2017, 58:1488-93. 10.1080/10428194.2016.1243681
- Montoro J, Gallur L, Merchán B, et al.: Аутоиммунные расстройства часто встречаются у пациентов с миелодиспластическим синдромом и оказывают неблагоприятное влияние на исходы. Энн Хематол. 2018, 97:1349-56. 10.1007/s00277-018-3302-0
- Fraison JB, Mekinian A, Grignano E, et al.: Эффективность азацитидина при аутоиммунных и воспалительных заболеваниях, связанных с миелодиспластическими синдромами и хроническим миеломоноцитарным лейкозом. Лейк Рез. 2016, 43:13-7.
 10.1016/j.leukres.2016.02.005
10.1016/j.leukres.2016.02.005 - Солари Э., Ициксон Р.: Как я лечу хронический миеломоноцитарный лейкоз. Кровь. 2017, 130:126-36. 10.1182/blood-2017-04-736421
Случай хронического миеломоноцитарного лейкоза, раскрытый после получения вакцины J&J COVID-19
Информация об авторе
Синдхуша Вирабали
Соответствующий автор
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Адитья Патель
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Гаутами Аре
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Амр Рамахи
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Сахити Читтамури
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Хамид Шаабан
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Заявление об этике и раскрытие информации о конфликте интересов
Люди: Согласие было получено или от него отказались все участники этого исследования. Конфликт интересов: В соответствии с единой формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Все авторы заявили, что никакая финансовая поддержка для представленной работы не была получена ни от одной организации. Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли повлиять на представленную работу.
Конфликт интересов: В соответствии с единой формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Все авторы заявили, что никакая финансовая поддержка для представленной работы не была получена ни от одной организации. Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли повлиять на представленную работу.
Информация о артикуле
ДОИ
10.7759/куреус.26070
Цитируйте эту статью как:
Веерабалли С., Патель А., Аре Г. и др. (18 июня 2022 г.) Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19. Куреус 14(6): e26070. doi:10. 7759/cureus.26070
7759/cureus.26070
История публикаций
Начало экспертной оценки: 10 июня 2022 г.
Экспертная проверка завершена: 14 июня 2022 г.
Опубликовано: 18 июня 2022 г.
Авторское право
© Copyright 2022
Veeraballi et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License CC-BY 4.0., которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.
Лицензия
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19
Цифры и т. д.

| До COVID до прививки (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
Стол
1: Сравнение общего анализа крови до и после введения вакцины против COVID-19.

Посмотреть крупнее
| До COVID до вакцинации (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
—
ОЦЕНКА 1 ЧИТАТЕЛЯ
РЕЙТИНГ
Scholarly Impact Quotient™ (SIQ™) — это наш уникальный процесс оценки рецензирования после публикации.
Узнайте больше здесь.
Что такое SIQ™?
Scholarly Impact Quotient™ (SIQ™) — это наш уникальный процесс оценки рецензирования после публикации. SIQ™ оценивает важность и качество статей, используя коллективный разум сообщества Cureus в целом. Всем зарегистрированным пользователям предлагается внести свой вклад в SIQ™ любой опубликованной статьи. (Авторы не могут оценивать свои собственные статьи.)
Высокие рейтинги должны быть зарезервированы за работу, которая является действительно новаторской в соответствующей области. Все, что выше 5, следует считать выше среднего.
Хотя все зарегистрированные пользователи Cureus могут оценивать любую опубликованную статью, мнение экспертов в предметной области имеет значительно больший вес, чем мнение неспециалистов. SIQ™ статьи будет отображаться рядом со статьей после того, как она будет дважды оценена, и пересчитывается с каждой дополнительной оценкой.
Посетите нашу страницу SIQ™, чтобы узнать больше.
Закрыть
Коэффициент научного влияния™ (SIQ™)
Scholarly Impact Quotient™ (SIQ™) — это наш уникальный процесс оценки рецензирования после публикации. SIQ™ оценивает важность и качество статей, используя коллективный разум сообщества Cureus в целом. Всем зарегистрированным пользователям предлагается внести свой вклад в SIQ™ любой опубликованной статьи. (Авторы не могут оценивать свои собственные статьи.)
У вас уже есть аккаунт?
Войти.
Введите адрес электронной почты, чтобы получить бесплатную загрузку в формате PDF.
Обратите внимание, что тем самым вы соглашаетесь быть добавленным в список рассылки нашего ежемесячного информационного бюллетеня по электронной почте.
Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J против COVID-19
Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19
Синдхуша Веерабалли, Адитья Патель, Гоутами Аре, Амр Рамахи, Сахити Читтамури, Хамид Шаабан
- Статья
- Авторы и т.
 д.
д.
- Метрики
- Цифры и т.д.
Синдхуша Веерабалли , Адитья Патель, Гаутами Аре, Амр Рамахи, Сахити Читтамури, Хамид Шаабан
Опубликовано:
18 июня 2022 г.
(см. историю)
DOI:
10.7759/куреус.26070
Цитируйте эту статью как:
Веерабалли С., Патель А., Аре Г. и др. (18 июня 2022 г.) Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19. Куреус 14(6): e26070. дои: 10.7759/cureus.26070
Abstract
Хронический миеломоноцитарный лейкоз (ХММЛ) — клональное заболевание гемопоэтических стволовых клеток, протекающее под перекрестным синдромом (миелодиспластические и миелопролиферативные заболевания). ХММЛ характеризуется моноцитозом периферической крови и дисплазией костного мозга. Патогенез ХММЛ изучен недостаточно. Хотя цитогенетические и молекулярные аномалии встречаются часто, они не являются диагностическими. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцина с редкой ассоциацией ограниченной склеродермии. На основании обзора статистики рака, эпидемиологии и конечных результатов (SEER) за 2014-2018 гг., пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000) по сравнению с женщинам (0,3/100 000). Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина. Наш случай предполагает возможность развития CMML после получения вакцины J&J COVID. Иммунизация всегда была мерой по спасению жизней в истории. Поскольку мир предвидит получение вакцины от COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцина с редкой ассоциацией ограниченной склеродермии. На основании обзора статистики рака, эпидемиологии и конечных результатов (SEER) за 2014-2018 гг., пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000) по сравнению с женщинам (0,3/100 000). Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина. Наш случай предполагает возможность развития CMML после получения вакцины J&J COVID. Иммунизация всегда была мерой по спасению жизней в истории. Поскольку мир предвидит получение вакцины от COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Введение
Перекрывающиеся синдромы миелодиспластического синдрома (МДС)/миелопролиферативного новообразования (МПН) представляют собой уникальные миелоидные новообразования с перекрывающимися признаками МДС и МПН. Они состоят из четырех нозий взрослых: хронический миеломоноцитарный лейкоз (CMML), MDS/MPN кольцевые сидеробласты-тромбоцитоз, BCR-ABL-1-отрицательный атипичный хронический миелоидный лейкоз (aCML) и MDS/MPN-неклассифицируемый; и одно педиатрическое заболевание, представляющее собой ювенильный миеломоноцитарный лейкоз [1]. ХММЛ характеризуется моноцитозом периферической крови и дисплазией костного мозга. Это обычно встречается у пожилых людей со средним возрастом при постановке диагноза от 65 до 75 лет и соотношением мужчин и женщин 1,5–3,1: 1 [2,3]. Клинические признаки ХММЛ неспецифичны; они связаны либо с миелопролиферативными симптомами, либо с симптомами, связанными с цитопениями. Патогенез ХММЛ изучен недостаточно. Хотя цитогенетические и молекулярные аномалии распространены, они не являются диагностическими [3,4]. Примерно у 20% пациентов имеются сопутствующие системные воспалительные и аутоиммунные заболевания (SIAD) [5-8]. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцины в сочетании с ограниченной склеродермией.
Примерно у 20% пациентов имеются сопутствующие системные воспалительные и аутоиммунные заболевания (SIAD) [5-8]. Здесь мы представляем редкий случай CMML после получения J&J COVID-19.вакцины в сочетании с ограниченной склеродермией.
Описание случая
74-летняя женщина с астмой, гипертензией и дислипидемией в анамнезе поступила в отделение неотложной помощи с жалобами на одышку и общую слабость в течение двух дней. Пациент сообщает, что симптомы начались после получения первой дозы вакцины Джонсона и Джонсона от COVID-19. Она была гемодинамически стабильной с частотой сердечных сокращений 94, частотой дыхания 21 и скоростью сатурации 9.9% на комнатном воздухе. Физикальное обследование в целом ничем не примечательно, за исключением уменьшения поступления воздуха с легкими диффузными хрипами с обеих сторон при аускультации легких. Цианоза и отека конечностей нет. Общий анализ крови показал гемоглобин 9,9 г/дл (норма: 12–15,5 г/дл), тромбоциты 37 × 10 3 /мкл (норма: 150–450 × 10 3 /мкл), лейкоциты количество 19,4 × 10 3 /мкл (норма: 4,4-11 × 10 3 /мкл) с дифференциалами, показывающими моноциты 11,5 x 10 3 /мкл (норма: 0,3 — 0,9 × 10 3 /мкл), лимфоциты 3,8 x 10 3 /мкл (норма: 0,9–2,9 x 10 3 /мкл), нейтрофилы 3,9 × 10 4 / 3 мкл (норма: 1,7–7 × 10 3 /мкл) и эозинофилы 0,1 × 10 3 /мкл (норма: 0–0,5 × 10 3 /мкл). Сравнение общего анализа крови до введения вакцины против COVID-19 и после введения вакцины против COVID-19 включено в Таблицу 1 .
Сравнение общего анализа крови до введения вакцины против COVID-19 и после введения вакцины против COVID-19 включено в Таблицу 1 .
| До COVID до прививки (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
Стол
1: Сравнение общего анализа крови до и после введения вакцины против COVID-19.

Анализы на гепатит и вирус иммунодефицита человека дали отрицательный результат. Тромбоцитопения была связана с вакцинозависимой иммунной тромбоцитопенической пурпурой (ИТП). Пациент получил снижающуюся дозу стероидов и две дозы внутривенного иммуноглобулина (1 г/кг) в качестве лечения ИТП, при этом наблюдалось лишь временное повышение уровня тромбоцитов. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Она также начала жаловаться на сухость во рту, затрудненное глотание и новые эпизоды побеления пальцев при низких температурах. Ревматологический анализ дал положительный результат на антицентромерные антитела и антитела Сойгрена к SSA. C-ANCA, P-ANCA, RF, анти-SSB и анти-склеродермия 70 были отрицательными. Криоглобулин, холодовые агглютинины и прямой тест также были отрицательными.
При последующем наблюдении было замечено, что у пациента прогрессирует тяжелая анемия и лейкоцитоз с постоянно высокими и повышающимися моноцитами. Проточная цитометрия биоптатов периферической крови и костного мозга проводилась для исключения лейкемии. Результаты биопсии костного мозга были значимыми для хронического миеломоноцитарного лейкоза стадии 0 (ХММЛ-0) в гиперцеллюлярном костном мозге. Бласты и промоноциты не увеличены; в условиях тяжелой анемии и тромбоцитопении с моноцитозом (AMC 12,6 K/мкл — 53,8% от общего числа лейкоцитов) соответствовал CMML 0. Секвенирование следующего поколения выявило вариации генов KRAS, NPM1 и TET2, а кариотипирование показало 46, XX женщин кариотипы. Проточная цитометрия показала моноцитоз (60%) и дисгранулопоэз без увеличения количества бластов или лимфопролиферативных нарушений. Количество CD34-позитивных миелобластов не увеличивается, и они составляют 0,4% от общего числа клеток. Количество моноцитов (60%) увеличено со снижением CD13 и CD14 и повышением уровня HLA-DR, что свидетельствует о смещении созревания влево. гранулоциты (19%) демонстрируют снижение бокового рассеяния, что свидетельствует о гипогранулярности со смещенным влево характером созревания CD13/CD16 и аберрантной коэкспрессией CD56, что свидетельствует о дисгранулопоэзе.
Результаты биопсии костного мозга были значимыми для хронического миеломоноцитарного лейкоза стадии 0 (ХММЛ-0) в гиперцеллюлярном костном мозге. Бласты и промоноциты не увеличены; в условиях тяжелой анемии и тромбоцитопении с моноцитозом (AMC 12,6 K/мкл — 53,8% от общего числа лейкоцитов) соответствовал CMML 0. Секвенирование следующего поколения выявило вариации генов KRAS, NPM1 и TET2, а кариотипирование показало 46, XX женщин кариотипы. Проточная цитометрия показала моноцитоз (60%) и дисгранулопоэз без увеличения количества бластов или лимфопролиферативных нарушений. Количество CD34-позитивных миелобластов не увеличивается, и они составляют 0,4% от общего числа клеток. Количество моноцитов (60%) увеличено со снижением CD13 и CD14 и повышением уровня HLA-DR, что свидетельствует о смещении созревания влево. гранулоциты (19%) демонстрируют снижение бокового рассеяния, что свидетельствует о гипогранулярности со смещенным влево характером созревания CD13/CD16 и аберрантной коэкспрессией CD56, что свидетельствует о дисгранулопоэзе. В-клетки (1,7%) являются политипными, а Т-клетки (8,2%) показывают нормальное соотношение CD4:CD8 без делеции пан-Т-клеточного антигена. Жизнеспособность составляет 91,13%. Панель ОМЛ в цитогенетическом исследовании FISH была отрицательной для RUNX1T1/RUNX1 (ETO/AML1), KMT2A (MLL), PML/RARA, реаранжировки CBFB, отрицательной для моносомии 5 и делеции CSF1R/RPS14 на длинном плече хромосомы 5. на q33, отрицательный на моносомию 7 и делецию MDFIC на длинном плече хромосомы 7 на q31. Панель MPN / CML также была отрицательной для перестройки BCR / ABL1, трисомии 8, 9., и делеция DLEU1, DLEU2 на длинном плече хромосомы 13 в q14 и делеция PTPRT на длинном плече хромосомы 20 в q12. Стратификация риска на основе молекулярной модели Мэйо классифицировала ее как группу высокого риска с оценкой 3 балла и среднюю степень риска с помощью модели GFM. Основываясь на функциональном состоянии и физической подготовке, пациентку отнесли к группе среднего риска, но она зависела от инфузии, поскольку она получила несколько трансфузий тромбоцитов и pRBC.
В-клетки (1,7%) являются политипными, а Т-клетки (8,2%) показывают нормальное соотношение CD4:CD8 без делеции пан-Т-клеточного антигена. Жизнеспособность составляет 91,13%. Панель ОМЛ в цитогенетическом исследовании FISH была отрицательной для RUNX1T1/RUNX1 (ETO/AML1), KMT2A (MLL), PML/RARA, реаранжировки CBFB, отрицательной для моносомии 5 и делеции CSF1R/RPS14 на длинном плече хромосомы 5. на q33, отрицательный на моносомию 7 и делецию MDFIC на длинном плече хромосомы 7 на q31. Панель MPN / CML также была отрицательной для перестройки BCR / ABL1, трисомии 8, 9., и делеция DLEU1, DLEU2 на длинном плече хромосомы 13 в q14 и делеция PTPRT на длинном плече хромосомы 20 в q12. Стратификация риска на основе молекулярной модели Мэйо классифицировала ее как группу высокого риска с оценкой 3 балла и среднюю степень риска с помощью модели GFM. Основываясь на функциональном состоянии и физической подготовке, пациентку отнесли к группе среднего риска, но она зависела от инфузии, поскольку она получила несколько трансфузий тромбоцитов и pRBC. В результате пациентке была начата терапия азацитидином, которая значительно улучшила количество клеток после двух циклов. Однако при дальнейшем наблюдении было обнаружено, что у нее развился ОМЛ, и она умерла из-за острой дыхательной недостаточности, вторичной по отношению к COVID-19.пневмония.
В результате пациентке была начата терапия азацитидином, которая значительно улучшила количество клеток после двух циклов. Однако при дальнейшем наблюдении было обнаружено, что у нее развился ОМЛ, и она умерла из-за острой дыхательной недостаточности, вторичной по отношению к COVID-19.пневмония.
Обсуждение
ХММЛ — редкое и агрессивное клональное новообразование гемопоэтических стволовых клеток, характеризующееся моноцитозом (≥10% количества лейкоцитов) [1]. Перекрывающиеся клинические, лабораторные и морфологические признаки миелодисплазии и миелопролиферации сделали ХММЛ подгруппой МДС/МПН в классификации опухолей кроветворной и лимфоидной тканей Всемирной организации здравоохранения (ВОЗ) [1]. На основании обзора статистики рака за 2014–2018 годы, проведенного в рамках обзора эпиднадзора, эпидемиологии и конечных результатов (SEER), пятилетний скорректированный по возрасту уровень заболеваемости ХММЛ у обоих полов составляет 0,5/100 000, с большей заболеваемостью у мужчин (0,7/100 000). по сравнению с женщинами (0,3/100 000). [2]. Диагностические критерии ХММЛ согласно рекомендациям ВОЗ включают стойкий моноцитоз периферической крови (≥1 × 10 9/л) с моноцитами, составляющими ≥10% количества лейкоцитов (лейкоцитов) в течение как минимум трех месяцев при исключении всех других причин моноцитоза и наличии <20% бластов в крови и костном мозге. Заболевания, которые следует исключить, включают лейкемию BCR-ABL1+, классическую МПН, острый миелоидный лейкоз и другие гематологические злокачественные новообразования [3]. Наличие мутаций, связанных с CMML, таких как TET2, SRSF2, SETBP1, ASXL1, подтверждает диагноз CMML. Кроме того, CMML подразделяется на CMML-0, CMML-1 и CMML-2 на основе бластных клеток ВОЗ, а также на миелодиспластический вариант и миелопролиферативный вариант на основе количества лейкоцитов Франко-американо-британским (FAB) кооперативом. Группа лейкозов [3,4]. Наш пациент с 3% бластных клеток в костном мозге относится к подгруппе CMML-0. Единственным вариантом лечения, модифицирующим заболевание, является аллогенная трансплантация стволовых клеток.
по сравнению с женщинами (0,3/100 000). [2]. Диагностические критерии ХММЛ согласно рекомендациям ВОЗ включают стойкий моноцитоз периферической крови (≥1 × 10 9/л) с моноцитами, составляющими ≥10% количества лейкоцитов (лейкоцитов) в течение как минимум трех месяцев при исключении всех других причин моноцитоза и наличии <20% бластов в крови и костном мозге. Заболевания, которые следует исключить, включают лейкемию BCR-ABL1+, классическую МПН, острый миелоидный лейкоз и другие гематологические злокачественные новообразования [3]. Наличие мутаций, связанных с CMML, таких как TET2, SRSF2, SETBP1, ASXL1, подтверждает диагноз CMML. Кроме того, CMML подразделяется на CMML-0, CMML-1 и CMML-2 на основе бластных клеток ВОЗ, а также на миелодиспластический вариант и миелопролиферативный вариант на основе количества лейкоцитов Франко-американо-британским (FAB) кооперативом. Группа лейкозов [3,4]. Наш пациент с 3% бластных клеток в костном мозге относится к подгруппе CMML-0. Единственным вариантом лечения, модифицирующим заболевание, является аллогенная трансплантация стволовых клеток. Но большинство пациентов остаются неподходящими, учитывая возраст начала заболевания и сопутствующие заболевания. Текущий терапевтический выбор зависит от симптомов, вызванных цитопенией или связанных с пролиферацией, которые включают стимулирующие эритропоэз агенты, циторедуктивные агенты и гипометилирующие агенты [9].,10]. В настоящее время проводится несколько клинических испытаний новых терапевтических возможностей для ХММЛ. Гипометилирующие агенты, такие как азацитидин, децитабин и пероральный децитабин/цедазуридин, были одобрены FDA США для лечения CMML [9,10].
Но большинство пациентов остаются неподходящими, учитывая возраст начала заболевания и сопутствующие заболевания. Текущий терапевтический выбор зависит от симптомов, вызванных цитопенией или связанных с пролиферацией, которые включают стимулирующие эритропоэз агенты, циторедуктивные агенты и гипометилирующие агенты [9].,10]. В настоящее время проводится несколько клинических испытаний новых терапевтических возможностей для ХММЛ. Гипометилирующие агенты, такие как азацитидин, децитабин и пероральный децитабин/цедазуридин, были одобрены FDA США для лечения CMML [9,10].
Более высокая распространенность SIAD была признана у пациентов с CMML по сравнению с населением в целом. Подсчитано, что 20% случаев ХММЛ связаны с SIAD [5]. В исследовании, проведенном Peker et al. из 123 пациентов с ХММЛ у 24 были выявлены аутоиммунные и воспалительные заболевания (АИЗ), из которых наиболее часто встречалась ИТП, затем следовали подагра, псориаз, рассеянный склероз, синдром Шегрена, ВЗК, аутоиммунная анемия и ревматическая полимиалгия, тогда как у четырех пациенты [6] имели более одного АИЗ. В другом исследовании, проведенном Zahid et al. [7] у 377 пациентов с ХММЛ у 77 пациентов (20%) был ассоциированный AID/SIS. Это исследование выявило гетерогенность СПИДа/SIS, связанного с CMML, причем наиболее распространенными являются неопределенные воспалительные синдромы, за которыми следуют ревматоидный артрит, псориаз, иммуноопосредованная тромбоцитопения, ревматическая полимиалгия и системный васкулит. У нашего пациента склеродермия с повышенным уровнем антител к центромере 2b и симптомами затрудненного глотания и феномена Рейно. У нее также синдром Шегрена с повышенным уровнем анти-SSA и сухостью во рту. Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина.
В другом исследовании, проведенном Zahid et al. [7] у 377 пациентов с ХММЛ у 77 пациентов (20%) был ассоциированный AID/SIS. Это исследование выявило гетерогенность СПИДа/SIS, связанного с CMML, причем наиболее распространенными являются неопределенные воспалительные синдромы, за которыми следуют ревматоидный артрит, псориаз, иммуноопосредованная тромбоцитопения, ревматическая полимиалгия и системный васкулит. У нашего пациента склеродермия с повышенным уровнем антител к центромере 2b и симптомами затрудненного глотания и феномена Рейно. У нее также синдром Шегрена с повышенным уровнем анти-SSA и сухостью во рту. Мы подчеркиваем тот факт, что, основываясь на предыдущих исследованиях, ассоциация склеродермии с ХММЛ встречается очень редко. У нашего пациента были сопутствующие ХММЛ и склеродермия, которые были разоблачены после того, как пациент получил COVID-19.вакцина.
Однако точный патогенез этой ассоциации еще предстоит определить. В системном обзоре, проведенном Ambinder et al. [5] обсуждалось множество убедительных биологических теорий патогенеза СПИДа при CMML, в том числе: (1) хроническое воспаление при аутоиммунных заболеваниях как триггер для CMML; (2) цитотоксические/иммуносупрессивные агенты, используемые при СПИДе как предрасполагающие факторы ХММЛ; (3) СПИД как следствие реакции иммунной системы на CMML 4. Клональные миелоидные элементы запускают СПИД. На основании имеющихся совокупных данных Ambinder et al. поддерживают гипотезу о том, что «SIAID являются следствием CMML». Несколько убедительных механизмов для вышеуказанной гипотезы включают аномальное поведение моноцитов и передачу сигналов, очевидную в клональном кроветворении, вызывающую избыточную экспрессию CD40 L, приводящую к системной красной волчанке (СКВ), избыточную экспрессию ICAM-1 и Ig-подобный лектин 1, связывающий сиаловую кислоту (Siglec-1), которые облегчают миграцию моноцитов в периферические ткани, что в конечном итоге приводит к увеличению экспрессии MHC-II и других костимулирующих молекул.
[5] обсуждалось множество убедительных биологических теорий патогенеза СПИДа при CMML, в том числе: (1) хроническое воспаление при аутоиммунных заболеваниях как триггер для CMML; (2) цитотоксические/иммуносупрессивные агенты, используемые при СПИДе как предрасполагающие факторы ХММЛ; (3) СПИД как следствие реакции иммунной системы на CMML 4. Клональные миелоидные элементы запускают СПИД. На основании имеющихся совокупных данных Ambinder et al. поддерживают гипотезу о том, что «SIAID являются следствием CMML». Несколько убедительных механизмов для вышеуказанной гипотезы включают аномальное поведение моноцитов и передачу сигналов, очевидную в клональном кроветворении, вызывающую избыточную экспрессию CD40 L, приводящую к системной красной волчанке (СКВ), избыточную экспрессию ICAM-1 и Ig-подобный лектин 1, связывающий сиаловую кислоту (Siglec-1), которые облегчают миграцию моноцитов в периферические ткани, что в конечном итоге приводит к увеличению экспрессии MHC-II и других костимулирующих молекул. апоптотические тельца увеличивают воздействие на организм аутоантигенов.Генетические аберрации в клональных миелоидных клетках могут вызывать SIAID, и это может объяснить симптомы SIAD до клинической картины CMML [5].Захид и др. обнаружили, что существует нет существенной разницы в общей выживаемости между пациентами с СПИДом и пациентами без СПИДа [7].С другой стороны, Montoro и др. сообщили p или общая выживаемость среди пациентов с сопутствующим МДС/ХММЛ и СИАИЗ [8].
апоптотические тельца увеличивают воздействие на организм аутоантигенов.Генетические аберрации в клональных миелоидных клетках могут вызывать SIAID, и это может объяснить симптомы SIAD до клинической картины CMML [5].Захид и др. обнаружили, что существует нет существенной разницы в общей выживаемости между пациентами с СПИДом и пациентами без СПИДа [7].С другой стороны, Montoro и др. сообщили p или общая выживаемость среди пациентов с сопутствующим МДС/ХММЛ и СИАИЗ [8].
В истории иммунизация всегда была средством спасения жизней. Он уже спас человечество от нескольких смертельных эпидемий и пандемий. Поскольку мир предвидит важность вакцины против COVID-19, важно сообщать обо всех возможных нежелательных явлениях для мониторинга безопасности. У нашей пациентки был нормальный общий анализ крови на исходном уровне, о чем свидетельствует анализ крови, полученный за шесть месяцев до того, как она получила вакцину против COVID-19. У нее были анемия, тромбоцитопения и лейкоцитоз через четыре дня после COVID-19. вакцина. При дальнейшем наблюдении тромбоциты продолжали снижаться, даже при резистентности к стероидам. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Постоянно повышенные моноциты повышали вероятность ХММЛ, что было подтверждено после исключения всех других возможных причин моноцитоза. Мы подозреваем, что вакцина против COVID-19 вызвала и разоблачила как ХММЛ, так и ассоциированную склеродермию у нашего пациента, учитывая острое начало и отсутствие других известных провоцирующих факторов.
вакцина. При дальнейшем наблюдении тромбоциты продолжали снижаться, даже при резистентности к стероидам. В конечном итоге у пациента развилась трансфузионно-зависимая тромбоцитопения. Постоянно повышенные моноциты повышали вероятность ХММЛ, что было подтверждено после исключения всех других возможных причин моноцитоза. Мы подозреваем, что вакцина против COVID-19 вызвала и разоблачила как ХММЛ, так и ассоциированную склеродермию у нашего пациента, учитывая острое начало и отсутствие других известных провоцирующих факторов.
Выводы
В настоящее время важность вакцины против COVID-19 неоспорима. Однако сообщение о возможных нежелательных явлениях помогает нам понять связанные с этим риски. Наш случай предполагает возможность развития CMML, связанного с ограниченной склеродермией, после получения вакцины J&J COVID. Однако необходимо провести дальнейшие исследования, чтобы подтвердить гипотезу и узнать патогенез ассоциации. Врачи должны знать об этом необычном осложнении вакцины, и необходимо больше случаев, чтобы подтвердить связь между ними.
Ссылки
- Арбер Д.А., Орази А., Хассерджян Р. и др.: Пересмотр 2016 г. классификации Всемирной организации здравоохранения миелоидных новообразований и острого лейкоза. Кровь. 2016, 127:2391-405. 10.1182/blood-2016-03-643544
- Обзор статистики рака SEER, CMML-2014-2018. (2019). Доступ: 4 апреля 2022 г.: https://seer.cancer.gov/statistics-network/explorer/application.html.
- Valent P, Orazi A, Savona MR, et al.: Предлагаемые диагностические критерии для классического хронического миеломоноцитарного лейкоза (CMML), вариантов CMML и состояний, предшествующих CMML. Гематология. 2019, 104:1935-49. 10.3324/haematol.2019.222059
- Patnaik MM, Tefferi A: Хронический миеломоноцитарный лейкоз: обновленная информация 2020 г. по диагностике, стратификации риска и лечению. Am J Гематол. 2020, 95:97-115. 10.1002/ajh.25684
- Амбиндер А.Дж., Миллер Дж., ДеЗерн А.Е.: Аутоиммунное заболевание при ХММЛ – курица или яйцо?. Best Pract Res Clin Haematol.
 2020, 33:101136. 10.1016/j.beha.2019.101136
2020, 33:101136. 10.1016/j.beha.2019.101136 - Peker D, Padron E, Bennett JM, et al.: Тесная связь аутоиммунных процессов и аутоиммунных заболеваний с хроническим миеломоноцитарным лейкозом: наблюдение из одного учреждения. Акта Гематол. 2015, 133:249-56. 10.1159/000365877
- Захид М.Ф., Баррако Д., Лашо Т.Л. и др.: Спектр аутоиммунных заболеваний и системных воспалительных синдромов у пациентов с хроническим миеломоноцитарным лейкозом. Лейк-лимфома. 2017, 58:1488-93. 10.1080/10428194.2016.1243681
- Montoro J, Gallur L, Merchán B, et al.: Аутоиммунные расстройства часто встречаются у пациентов с миелодиспластическим синдромом и оказывают неблагоприятное влияние на исходы. Энн Хематол. 2018, 97:1349-56. 10.1007/s00277-018-3302-0
- Fraison JB, Mekinian A, Grignano E, et al.: Эффективность азацитидина при аутоиммунных и воспалительных заболеваниях, связанных с миелодиспластическими синдромами и хроническим миеломоноцитарным лейкозом. Лейк Рез. 2016, 43:13-7.
 10.1016/j.leukres.2016.02.005
10.1016/j.leukres.2016.02.005 - Солари Э., Ициксон Р.: Как я лечу хронический миеломоноцитарный лейкоз. Кровь. 2017, 130:126-36. 10.1182/blood-2017-04-736421
Случай хронического миеломоноцитарного лейкоза, раскрытый после получения вакцины J&J COVID-19
Информация об авторе
Синдхуша Вирабали
Соответствующий автор
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Адитья Патель
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Гаутами Аре
Терапия, Медицинский центр Святого Михаила, Ньюарк, США
Амр Рамахи
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Сахити Читтамури
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Хамид Шаабан
Гематология и онкология, Медицинский центр Святого Михаила, Ньюарк, США
Заявление об этике и раскрытие информации о конфликте интересов
Люди: Согласие было получено или от него отказались все участники этого исследования. Конфликт интересов: В соответствии с единой формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Все авторы заявили, что никакая финансовая поддержка для представленной работы не была получена ни от одной организации. Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли повлиять на представленную работу.
Конфликт интересов: В соответствии с единой формой раскрытия информации ICMJE все авторы заявляют следующее: Информация об оплате/услугах: Все авторы заявили, что никакая финансовая поддержка для представленной работы не была получена ни от одной организации. Финансовые отношения: Все авторы заявили, что у них нет финансовых отношений в настоящее время или в течение предыдущих трех лет с какими-либо организациями, которые могут быть заинтересованы в представленной работе. Другие отношения: Все авторы заявили об отсутствии других отношений или действий, которые могли повлиять на представленную работу.
Информация о артикуле
ДОИ
10.7759/куреус.26070
Цитируйте эту статью как:
Веерабалли С., Патель А., Аре Г. и др. (18 июня 2022 г.) Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19. Куреус 14(6): e26070. doi:10. 7759/cureus.26070
7759/cureus.26070
История публикаций
Начало экспертной оценки: 10 июня 2022 г.
Экспертная проверка завершена: 14 июня 2022 г.
Опубликовано: 18 июня 2022 г.
Авторское право
© Copyright 2022
Veeraballi et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License CC-BY 4.0., которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания оригинального автора и источника.
Лицензия
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Случай хронического миеломоноцитарного лейкоза, разоблаченный после получения вакцины J&J COVID-19
Цифры и т. д.

| До COVID до прививки (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
Стол
1: Сравнение общего анализа крови до и после введения вакцины против COVID-19.

Посмотреть крупнее
| До COVID до вакцинации (10/2020) | Через четыре дня после вакцинации против COVID-19 — J&J (12.05.21) | Через месяц после вакцинации против COVID (18.06.21) | Опорные значения | |
| Гемоглобин | 11,8 | 9,9 | 6,8 | 12–15,5 г/дл |
| Гематокрит | 35,8 | 29,5 | 20 | 34,9–44,5% |
| Эритроциты | 3,77 | 3,01 | 1,99 | 3,9–5,03 × 10 6 /мкл |
| Лейкоциты | 6,3 | 19,4 | 34,5 | 4,4–11 × 10 3 /мкл |
| Абсолютные нейтрофилы | 3,7 | 3,9 | 9,6 | 1,7–7 × 10 3 /мкл |
| Абсолютные моноциты | 0,6 | 11,5 | 19,1 | 0,3–0,9 × 10 3 /мкл |
| Абсолютные эозинофилы | 0,2 | 0,1 | 0,0 | 0–0,5 × 10 3 /мкл |
| Абсолютные лимфоциты | 1,8 | 3,8 | 5,5 | 0,9–2,9 × 10 3 /мкл |
| Тромбоциты | 199 | 37 | 10 | 150–450 × 10 3 /мкл |
| Количество ретикулоцитов | нет данных | нет данных | 1,9 | 0,5–1,5% |
—
ОЦЕНКА 1 ЧИТАТЕЛЯ
РЕЙТИНГ
Scholarly Impact Quotient™ (SIQ™) — это наш уникальный процесс оценки рецензирования после публикации.
Узнайте больше здесь.
Что такое SIQ™?
Scholarly Impact Quotient™ (SIQ™) — это наш уникальный процесс оценки рецензирования после публикации. SIQ™ оценивает важность и качество статей, используя коллективный разум сообщества Cureus в целом. Всем зарегистрированным пользователям предлагается внести свой вклад в SIQ™ любой опубликованной статьи. (Авторы не могут оценивать свои собственные статьи.)
Высокие рейтинги должны быть зарезервированы за работу, которая является действительно новаторской в соответствующей области. Все, что выше 5, следует считать выше среднего.
Хотя все зарегистрированные пользователи Cureus могут оценивать любую опубликованную статью, мнение экспертов в предметной области имеет значительно больший вес, чем мнение неспециалистов. SIQ™ статьи будет отображаться рядом со статьей после того, как она будет дважды оценена, и пересчитывается с каждой дополнительной оценкой.
Посетите нашу страницу SIQ™, чтобы узнать больше.

 д.
д. 2020, 33:101136. 10.1016/j.beha.2019.101136
2020, 33:101136. 10.1016/j.beha.2019.101136 10.1016/j.leukres.2016.02.005
10.1016/j.leukres.2016.02.005