Содержание
Как подготовиться к прививке от коронавируса и что важно знать?
Вакцина пришла в Тюмень, и наших иммунологов буквально засыпали вопросами: «надо прививаться?», «а можно ли мне вакцинироваться сейчас?». Давайте внесем ясность.
Во-1х, сразу «на входе»: Все имеющиеся сегодня анти-коронавирусные вакцины очень (очень!) новые, и ни у кого из исследователей и врачей пока просто нет опыта длительного наблюдения за привитыми именно ими. Поэтому, быть может, многие позиции будут пересмотрены в ближайшие 3-5 лет.
Во-2х, для кого вакцинация уже разрешена:
- взрослые, в целом здоровые люди, не переболевшие COVID-19 и не имеющие антител к вирусу SARS-CoV2.
Для кого – не разрешена:
- дети до 18 лет
-
беременные и кормящие женщины (исключением является вакцина ГАМ-КОВИД-ВАК (Спутник V) и Спутник Лайт с октября 2021 года).
-
люди с тяжелыми (анафилактическими) реакциями на любой из компонентов вакцины в прошлом или имеющие/имевшие тяжелые аллергические заболевания. Например, не будет вводиться вторая доза вакцины тем, у кого такая реакция произойдет на первую; тем, кто перенес синдром Лайелла или Стивенса-Джонсона. -
люди с первичным иммунодефицитом, с онко-гематологическими заболеваниями и на иммуносупрессивной терапии, при декомпенсации тяжелых заболеваний. Для вакцины «ЭпивакКорона» пока актуально и верхнее возрастное ограничение разрешенного возраста (вакцинируют только 18-60 летних).
В 3-их, о временных противопоказаниях для введения вакцины. Тут – общее правило, абсолютно как и для любой иной вакцины:
- в период острых заболеваний и обострения хронических вакцинация не выполняется,
- вакцина не вводится, если еще не истек 1 месяц от последней выполненной вакцинации.

Ну а дальше – еще немного информации о том, как вакцинация переносится дугими людьми, и что вы можете предпринять, чтобы в вашем случае вакцинальный процесс протекал благоприятно.
ПЕРЕД ВАКЦИНАЦИЕЙ ПРОТИВ КОРОНАВИРУСА каждый заполняет короткую анкету. Там вы отмечаете, контактировали ли с больными людьми в течение последних двух недель и есть ли у вас симптомы COVID-19. Если да, вам делают тест на наличие коронавируса SARS-CoV-2. Так написано в документе Минздрава. Но на деле тест делают далеко не везде. Пришел, привился ― и до следующей встречи. Напомним, что вакцину вводят в два этапа ― с интервалом в 21 день.
Осмотр врача обязателен!!!
Перед проведением вакцинации вас должен осмотреть врач. Он соберет анамнез, измерит температуру (если температура превышает 37 °С, вакцинироваться не разрешат), сатурацию (уровень кислорода в крови), частоту сердечного ритма, давление, послушает сердце и легкие и посмотрит горло. Врач расскажет о возможных реакциях на введение вакцины. Возможно развитие аллергических реакций на компоненты вакцины, поэтому после прививки (как всегда!) нужно на полчаса задержаться в поликлинике.
Врач расскажет о возможных реакциях на введение вакцины. Возможно развитие аллергических реакций на компоненты вакцины, поэтому после прививки (как всегда!) нужно на полчаса задержаться в поликлинике.
После вакцинации в первые-вторые сутки могут появиться симптомы, как при гриппе: озноб, температура, боль в мышцах, головная боль и общее недомогание. Также могут появиться болезненность, покраснение и отек в месте инъекции. Реже отмечаются тошнота, боль в животе, снижение аппетита, иногда ― увеличение лимфоузлов. При покраснении, отечности, болезненности в месте укола можно принять свой антигистаминный препарат, нанести «траумель». При повышении температуры тела ― нестероидные противовоспалительные препараты (как ибупрофен или парацетамол).
Напомним, если после вакцины появились серьезные осложнения (анафилактический шок, температура выше 40 °С, тяжелые аллергические реакции), вводить второй компонент противопоказано.
В течение 3 дней после вакцинации Минздрав не рекомендует мочить место инъекции, ходить в сауну, баню, пить любой алкоголь, интенсивно заниматься спортом.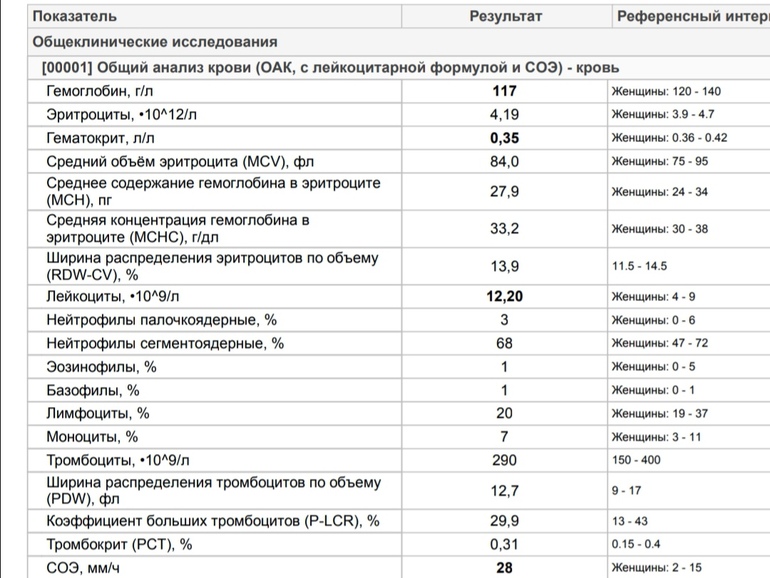 Рекомендации эти скорее традиционные, хорошей научной базы под ними нет и в инструкции о них ни слова.
Рекомендации эти скорее традиционные, хорошей научной базы под ними нет и в инструкции о них ни слова.
Пока неизвестно, сколько времени вы будете защищены после прививки. Также неизвестно, что длится дольше: иммунитет после заражения COVID-19 или после прививки. Известно лишь, что на 42-е сутки от начала вакцинации «Спутником V» в крови обнаруживают антитела к вирусу SARS-CoV-2 со средним титром 49,3. Это неплохой показатель. У переболевших к 42-му дню титр составляет порядка 80, но затем снижается.
Даже если вы сами будете защищены вакциной довольно долго, по-прежнему есть риск передачи вируса другим. После вакцинации, как и после выздоровления от COVID-19 нужно по-прежнему носить маски и соблюдать социальную дистанцию, часто мыть руки и проветривать помещение. Насколько он высок, ученым только предстоит выяснить. Массовая вакцинация началась недавно, поэтому нужно время на то, чтобы собрать достоверные данные.
Иммунограмма перед вакцинацией? | mamaclub
Вакцинация вызывает ожесточенные споры на женских форумах и даже медцинских порталах. К сожалению, сегодня в нашем мире стало модно «пугать» людей, выпускать всевозможные «правды о… » и вести журналистские расследования, в которых человек в затемненном помещении, не называя своего имени, уличает всех вокруг и спешит раскрыть очередную теорию заговора. В этом году самая «модная» тема подобных страшилок – конец света. А вот прививки попали еще в самую первую волну этой «моды».
К сожалению, сегодня в нашем мире стало модно «пугать» людей, выпускать всевозможные «правды о… » и вести журналистские расследования, в которых человек в затемненном помещении, не называя своего имени, уличает всех вокруг и спешит раскрыть очередную теорию заговора. В этом году самая «модная» тема подобных страшилок – конец света. А вот прививки попали еще в самую первую волну этой «моды».
Именно поэтому все чаще педиатры слышат требование провести перед каждой прививкой, включая пробу Манту (которая, напомним, не является прививкой), специальный анализ крови для определения иммунного статуса или, другими словами, сделать иммунограмму. Большинство из этих мам уверены, что за границей перед каждой прививкой детям делают подобный анализ. Но так ли это?
На самом деле такой практики нет нигде в мире. Более того, иммунограмма представляет собой настолько сложный и спорный анализ, что ее назначение производится только по строгим показаниями. К тому же, ее результаты должен читать только специалист — иммунолог, который тщательно изучит семейный и личный анамнез ребенка и только потом сможет сделать какие-то выводы.
Видео дня
Что такое иммунограмма
Иммунограмма представляет собой анализ крови, объектом исследования которого являются компоненты иммунной системы: лейкоциты, фагоциты, макрофаги, иммуноглобулины, антитела и т.д. В ходе исследования изучается не только количество таких клеток, но и высчитывается их процентное соотношение, рассматривается активность и многое другое. Словом, на первый взгляд, это полное исследование основных характеристик и показателей иммунной системы пациента.
Анализ делают далеко не все лаборатории и, в большинстве случаев, он платный, особенно, если его назначение не показано. Для исследования берут только венозную кровь.
Здесь следует напомнить, что график прививок предусматривает первую вакцинацию в первый день жизни, затем на третий день, затем в месяц, три, четыре, пять и год. Забор крови из вены у ребенка такого возраста в большинстве случаев простым не назовешь и целесообразность подвергать грудничка этому испытанию весьма сомнительна. К тому же, многие специалисты утверждают, что до полугода, пока собственный иммунитет ребенка работает слабо, а в его крови еще множество антител, доставшихся от матери, иммунограмма вообще не информативна.
К тому же, многие специалисты утверждают, что до полугода, пока собственный иммунитет ребенка работает слабо, а в его крови еще множество антител, доставшихся от матери, иммунограмма вообще не информативна.
В каких случаях нужна иммунограмма
Помимо желания родителей провести иммунограмму перед вакцинацией, нередко можно столкнуться с тем, что анализ назначают детям, которые часто болеют ОРВЗ. Имеет ли это смысл?
Без сомнений, иммунитет играет первостепенную роль в том, как часто и как тяжело ребенок болеет инфекционными заболеваниями. Однако функционирование иммунной системы настолько сложно и не до конца изучено, что в настоящее время исследования говорят о том, что иммунограмма у часто болеющих детей, как правило, незначительно отличается от нормы. Только грубые патологии иммунной системы отчетливо отображаются в результатах иммунограммы.
Назначать иммунограмму должен только специалист – аллерголог-иммунолог. Он же должен читать ее результаты, ведь даже высококвалифицированный, опытный педиатр вряд ли корректно интерпретирует ее результаты. И уж тем более, этого не должны делать родители ребенка.
И уж тем более, этого не должны делать родители ребенка.
Анализ на определение иммунного статуса показан в случае ВИЧ-инфицирования, при приеме иммунодепрессантов, при наличии онкологических заболеваний и//или проведении химиотерапии, при подозрениях на первичный иммунодефицит, обусловленный генетическими нарушениями и характерный для детей младшего возраста, а также в послеоперационном и реабилитационном периоде после пересадки органов. Среди показаний к проведению анализа вакцинация не упоминается.
Материалы на этом сайте рекомендованы для общего информационного использования и не предназначены для установления диагноза или самостоятельного лечения. Медицинские эксперты MedOboz гарантируют, что весь контент, который мы размещаем, публикуется и соответствует самым высоким медицинским стандартам. Наша цель – максимально качественно информировать читателей о симптомах, причинах и методах диагностики заболеваний. Призываем не заниматься самолечением, а для диагностики заболеваний и определения методов их лечения советуем обращаться к врачам.
Популярные врачи
Лекарства
У каждого восьмого пациента с COVID-19 развиваются длительные симптомы COVID: Исследование
NewsDesk.
Изображение Пита Линфорта с Pixabay
Исследование представляет собой одно из первых сравнений долгосрочных симптомов после заражения SARS-CoV-2 (часто называемое «длительным COVID») с симптомами у неинфицированного населения, а также измерение симптомов. у людей как до, так и после COVID-19инфекционное заболевание. Включение неинфицированных групп населения позволяет более точно прогнозировать долгосрочную распространенность симптомов COVID-19, а также улучшать идентификацию основных симптомов длительного COVID.
«Существует острая необходимость в данных, информирующих о масштабах и масштабах долгосрочных симптомов, испытываемых некоторыми пациентами после болезни COVID-19». — говорит профессор Джудит Росмален из Университета Гронингена, ведущий автор исследования.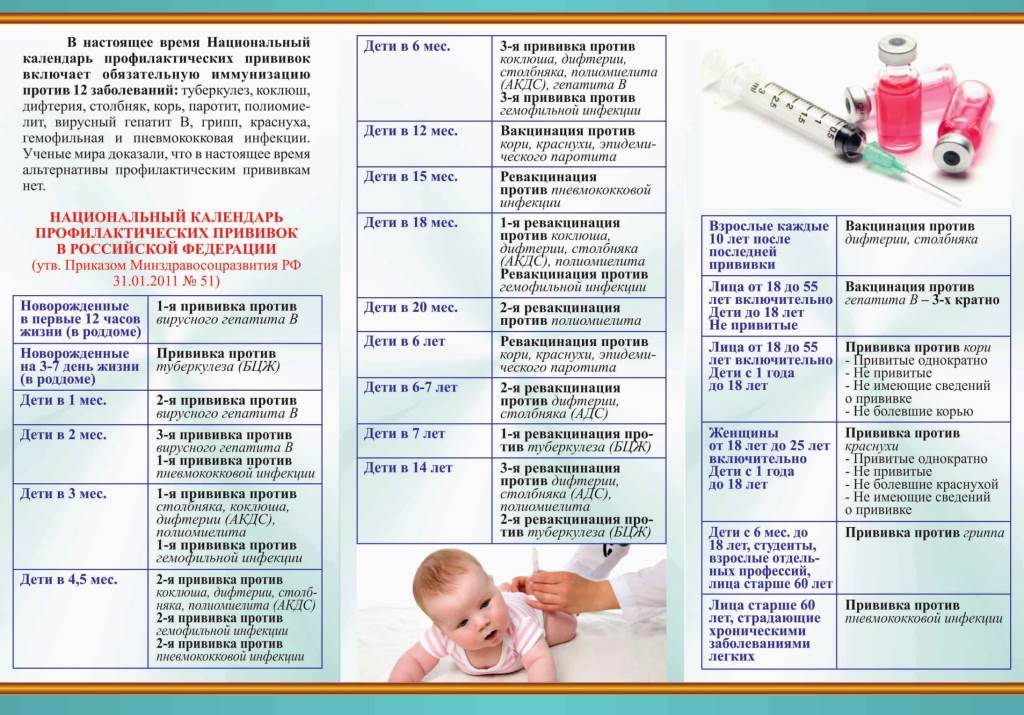 «Однако в большинстве предыдущих исследований длительного COVID не рассматривалась частота этих симптомов у людей, у которых не был диагностирован COVID-19.или смотрели на симптомы отдельных пациентов до постановки диагноза COVID-19».
«Однако в большинстве предыдущих исследований длительного COVID не рассматривалась частота этих симптомов у людей, у которых не был диагностирован COVID-19.или смотрели на симптомы отдельных пациентов до постановки диагноза COVID-19».
Профессор Росмален продолжает: «Наш подход к исследованию рассматривает симптомы, наиболее часто связанные с длительным течением COVID, включая проблемы с дыханием, утомляемость и потерю вкуса и/или обоняния, как до постановки диагноза COVID-19, так и у людей, у которых еще не был диагностирован COVID-19. с COVID-19. Этот метод позволяет нам принимать во внимание ранее существовавшие симптомы и симптомы у неинфицированных людей, чтобы предложить улучшенное рабочее определение длительной COVID-19 и дать надежную оценку того, какова вероятность длительности COVID-19.должно произойти в общей популяции».
В этом новом исследовании, проведенном в Нидерландах, исследователи собрали данные, попросив участников популяционной когорты Lifelines COVID-19 регулярно заполнять цифровые анкеты по 23 симптомам, обычно связанным с длительным течением COVID. Анкета была разослана одним и тем же лицам 24 раза в период с марта 2020 года по август 2021 года, что означает, что участники, переболевшие COVID-19 в это время, были инфицированы альфа-вариантом SARS-CoV-2 или более ранними вариантами. Большая часть данных была собрана до пандемии COVID-19.развертывание вакцины в Нидерландах, поэтому количество вакцинированных участников было слишком маленьким для анализа в этом исследовании.
Анкета была разослана одним и тем же лицам 24 раза в период с марта 2020 года по август 2021 года, что означает, что участники, переболевшие COVID-19 в это время, были инфицированы альфа-вариантом SARS-CoV-2 или более ранними вариантами. Большая часть данных была собрана до пандемии COVID-19.развертывание вакцины в Нидерландах, поэтому количество вакцинированных участников было слишком маленьким для анализа в этом исследовании.
Участники регистрировались как положительные на COVID-19, если у них был либо положительный тест, либо диагноз COVID-19, поставленный врачом. Из 76 422 участников 4 231 (5,5%) участник, у которых был COVID-19, были сопоставлены с 8 462 участниками контрольной группы с учетом пола, возраста и времени заполнения анкет, указывающих на диагноз COVID-19.
Исследователи обнаружили, что некоторые симптомы были новыми или более серьезными через три-пять месяцев после заражения COVID-19., по сравнению с симптомами до постановки диагноза COVID-19 и с контрольной группой, что позволяет предположить, что эти симптомы можно рассматривать как основные симптомы длительного COVID.
Основными зарегистрированными симптомами были боль в груди, затрудненное дыхание, боль при дыхании, болезненные ощущения в мышцах, потеря вкуса и/или обоняния, покалывание в руках/ногах, ком в горле, поочередное ощущение жара и холода, тяжесть в руках и/или ногах и общая усталость. Тяжесть этих симптомов стабилизировалась через три месяца после заражения без дальнейшего снижения. Другие симптомы, которые значительно не усилились через три-пять месяцев после заражения COVID-19.диагноз включал головную боль, зуд в глазах, головокружение, боль в спине и тошноту.
Кандидат наук и первый автор исследования Аранка Баллеринг говорит: «Эти основные симптомы имеют важное значение для будущих исследований, поскольку их можно использовать для различения состояний после COVID-19 и симптомов, не связанных с COVID-19. ”
Среди участников исследования, предоставивших данные о симптомах до COVID, исследователи обнаружили, что 21,4% (381/1782) участников с положительным результатом на COVID-19 по сравнению с 8,7% (361/4130) в контрольной группе испытывали как минимум один усиленный основной симптом средней степени тяжести через 3 месяца или более после заражения SARs-CoV-2. Это означает, что в 12,7% случаев COVID-19у пациентов их новые или сильно обострившиеся симптомы через три месяца после COVID можно отнести к инфекции SARS-CoV-2.
Это означает, что в 12,7% случаев COVID-19у пациентов их новые или сильно обострившиеся симптомы через три месяца после COVID можно отнести к инфекции SARS-CoV-2.
Аранка Баллеринг добавляет: «Изучая симптомы в неинфицированной контрольной группе и у людей как до, так и после заражения SARS-CoV-2, мы смогли объяснить симптомы, которые могли быть результатом неинфекционных аспектов здоровья. пандемии, например, стресс, вызванный ограничениями и неопределенностью».
Она продолжает: «Состояние после COVID-19, также известное как длительный COVID, является неотложной проблемой с растущими человеческими жертвами. Понимание основных симптомов и распространенности пост-COVID-19среди населения в целом представляет собой важный шаг вперед в нашей способности разрабатывать исследования, которые в конечном итоге могут дать информацию об успешных ответных мерах здравоохранения на долгосрочные симптомы COVID-19». [1]
Авторы признают некоторые ограничения исследования. Это исследование включало пациентов, инфицированных альфа-вариантом или более ранними вариантами SARS-CoV-2, и не содержит данных о людях, инфицированных в период, когда дельта- или омикронные варианты вызывали большинство инфекций. Кроме того, из-за бессимптомной инфекции распространенность COVID-19в этом исследовании могут быть недооценены. Еще одно ограничение этого исследования заключается в том, что с самого начала сбора данных другие симптомы, такие как туман в голове, были определены как потенциально важные для определения длительного COVID, но в этом исследовании эти симптомы не рассматривались. Кроме того, исследование проводилось в одном регионе и не включало этнически разнообразное население.
Кроме того, из-за бессимптомной инфекции распространенность COVID-19в этом исследовании могут быть недооценены. Еще одно ограничение этого исследования заключается в том, что с самого начала сбора данных другие симптомы, такие как туман в голове, были определены как потенциально важные для определения длительного COVID, но в этом исследовании эти симптомы не рассматривались. Кроме того, исследование проводилось в одном регионе и не включало этнически разнообразное население.
Профессор Джудит Росмален говорит: «Будущие исследования должны включать симптомы психического здоровья (например, симптомы депрессии и тревоги), а также дополнительные постинфекционные симптомы, которые мы не смогли оценить в этом исследовании (такие как туман в голове, бессонница и недомогание после физической нагрузки). ). Нам не удалось выяснить, что может вызвать любой из симптомов, наблюдаемых после COVID-19.в этом исследовании, но мы надеемся, что будущие исследования смогут дать представление о задействованных механизмах. Кроме того, из-за сроков проведения этого исследования мы не смогли оценить влияние вакцинации против COVID-19 и различных вариантов SARS-CoV-2 на продолжительные симптомы COVID. Мы надеемся, что будущие исследования дадут ответы на вопрос о влиянии этих факторов».
Кроме того, из-за сроков проведения этого исследования мы не смогли оценить влияние вакцинации против COVID-19 и различных вариантов SARS-CoV-2 на продолжительные симптомы COVID. Мы надеемся, что будущие исследования дадут ответы на вопрос о влиянии этих факторов».
- В Западной Вирджинии выявлен случай свиного гриппа
- Литва сообщает о первом случае обезьяньей оспы
- ДР Конго: число случаев оспы обезьян превысило 2000, число случаев брюшного тифа превысило 1 миллион
- Род-Айленд сообщает о случае вируса Джеймстаун-Каньон в округе Вашингтон
- Калифорния: случай энцефалита Сент-Луиса зарегистрирован в округе Туларе
- За последние 15 лет в США наблюдается заметный рост болезни Лайма: Исследование
- Ирак сообщает о новых случаях/смертях от Конго-крымской геморрагической лихорадки
- Боливия: из каждых 10 беременных женщин у 2 положительный результат теста на Шагаса в Тарихе
- Чума в ДРК: за четыре месяца в медико-санитарной зоне Рети зарегистрировано более 500 подозрительных случаев
Иммунотерапия рака: от лаборатории к клиническому применению.
 Потенциальное влияние на организацию онкологических центров
Потенциальное влияние на организацию онкологических центров
Linda Cairns 1 , Sandrine Aspeslagh 2 , Andrea Anichini 3 , Jon Amund Kyte 4 , Christian Blank 5 , Paolo Ascierto 6 , Nicolle Rekers 7 , Per Thor Straten 8 и Ахмад Авада 9
1 Европейский институт онкологии, Via Ripamonti, 435, 20141 Милан. Италия
2 Gustave Roussy, 114 rue Edouard Vaillant, 94805 Villejuif cedex, Франция
3 Fondazione IRCCS Istituto Nazionale dei Tumori, Via Giacomo Venezian, 1, 20133 Милан, Италия
4 Университетская больница Осло, почтовый ящик 4950 Нидален, 0424 Осло, Норвегия
5 Нидерландский институт рака, Plesmanlaan 121, 1066 CX Amsterdam, Нидерланды
6 Istituto Nazionale Tumori IRCCS «Fondazione G. Pascale», Via Mariano Semmola, 80131 Неаполь, Италия
7 Медицинский центр Маастрихтского университета, Маастрихт UMC P. Debyelaan 25 6229 HX Maastricht, Нидерланды
Debyelaan 25 6229 HX Maastricht, Нидерланды
8 Университет Копенгагена Госпиталь Херлев, Herlev Ringvej 75, 2730 Herlev, Дания
9 Institut Jules Bordet, 1, rue Héger-Bordet, 1000 Брюссель, Бельгия
Адрес для переписки: Линда Кэрнс. Электронная почта: [email protected]
Аннотация
В этом отчете рассматриваются сеансы иммунотерапии на собрании Дней онкологии Организации европейских институтов рака (OECI) 2016 г., которое состоялось 15–17 июня 2016 г. в Брюсселе, Бельгия. Иммунотерапия — это потенциальное лечение рака, при котором иммунная система человека используется для борьбы с опухолью. В последние годы в этой области были достигнуты значительные успехи в лечении некоторых запущенных форм рака. Иммунотерапия рака включает моноклональные антитела, которые предназначены для атаки на очень специфическую часть раковой клетки, и ингибиторы иммунных контрольных точек, которые представляют собой молекулы, которые стимулируют или блокируют ингибирование иммунной системы. Другие методы иммунотерапии рака включают вакцины и инфузии Т-клеток. В этом отчете будут обобщены некоторые исследования, которые проводятся в этой области, и будет представлена обновленная информация о том, где мы находимся в настоящее время.
Другие методы иммунотерапии рака включают вакцины и инфузии Т-клеток. В этом отчете будут обобщены некоторые исследования, которые проводятся в этой области, и будет представлена обновленная информация о том, где мы находимся в настоящее время.
Ключевые слова: иммунотерапия, моноклональные антитела, противораковые вакцины
Copyright: © авторов; лицензиат e онкологическая медицина. Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License (http://creativecommons.org/licenses/by/3.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинальная работа правильно процитировано.
Опубликовано: 11.10.2016; Поступила в редакцию: 24.10.2016
Сессия 1: История лаборатории и текущие разработки
Sandrine Aspeslagh от Gustave Roussy выступила с презентацией под названием «Экспериментальные доказательства иммуноопосредованной гибели клеток во время химиотерапии и лучевой терапии». Она обсудила механизмы и ключевое значение иммуногенной гибели клеток (ICD). Она также обсудила механизм активации иммунной системы, который запускается клеточным стрессом, вызванным химиотерапией, и то, как он считается важным для ответа на лечение и индукции стойкого постхимиотерапевтического иммунитета. Опухоли, у которых отсутствует этот механизм, хуже поддаются лечению и имеют худший прогноз. Некоторые типы традиционных противораковых методов лечения, таких как химиотерапия и лучевая терапия, действительно вызывают ИКД и приводят к терапевтическому успеху у иммунокомпетентных, но не иммунодефицитных пациентов. Этот тип гибели клеток активирует иммунные пути, включающие кальретикулин, АТФ и HMGB1, что приводит к более адекватной иммунной реакции на раковые клетки и, таким образом, усиливает противоопухолевый потенциал. В эпоху блокады иммунных контрольных точек крайне важно понять эти механизмы, чтобы предложить более рациональные комбинаторные режимы для пациентов, резистентных к иммунным контрольным точкам.
Она обсудила механизмы и ключевое значение иммуногенной гибели клеток (ICD). Она также обсудила механизм активации иммунной системы, который запускается клеточным стрессом, вызванным химиотерапией, и то, как он считается важным для ответа на лечение и индукции стойкого постхимиотерапевтического иммунитета. Опухоли, у которых отсутствует этот механизм, хуже поддаются лечению и имеют худший прогноз. Некоторые типы традиционных противораковых методов лечения, таких как химиотерапия и лучевая терапия, действительно вызывают ИКД и приводят к терапевтическому успеху у иммунокомпетентных, но не иммунодефицитных пациентов. Этот тип гибели клеток активирует иммунные пути, включающие кальретикулин, АТФ и HMGB1, что приводит к более адекватной иммунной реакции на раковые клетки и, таким образом, усиливает противоопухолевый потенциал. В эпоху блокады иммунных контрольных точек крайне важно понять эти механизмы, чтобы предложить более рациональные комбинаторные режимы для пациентов, резистентных к иммунным контрольным точкам.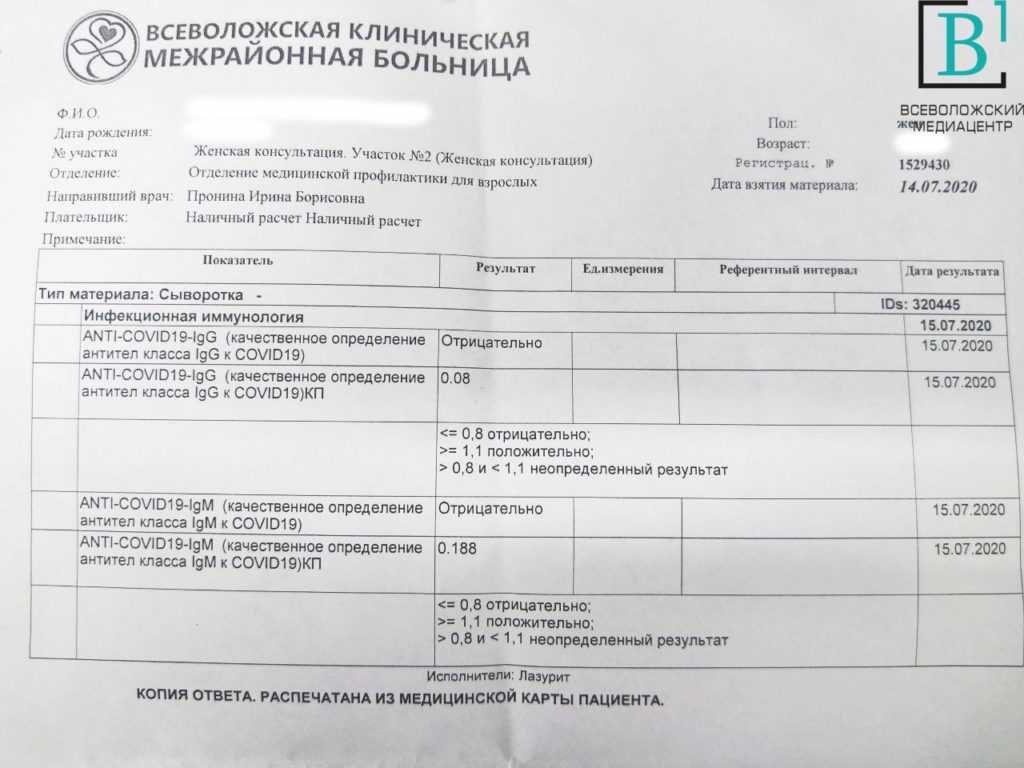
Андреа Аничини из Национального института опухолей в Милане обсудила «Технологии и современные трансляционные подходы в иммунотерапии». За последние шесть лет результаты нескольких фаз I-III клинических испытаний иммунотерапии рака, нацеленной на иммунные контрольные точки (первоначально CTLA-4, а затем ось PD-1/PD-L1), способствовали заре новой эры в лечении рака. несколько запущенных видов рака, включая меланому, немелкоклеточный рак легкого (НМРЛ), уротелиальный рак, рак почки, плоскоклеточный рак головы и шеи, трижды негативный рак молочной железы, рак желудка, колоректальный рак, карциному из клеток Меркеля и лимфому Ходжкина. Несмотря на эти замечательные улучшения в лечении некоторых распространенных видов рака, только часть пациентов достигает клинической пользы от иммунотерапии. Недавние технологические разработки в области патологии и иммунопатологии, а также геномного и иммунологического анализа опухолевых поражений способствовали разработке эффективных трансляционных подходов, которые позволяют понять механизмы ответа и устойчивости к иммунотерапии. Это помогает определить, какие подмножества опухолей имеют молекулярный и иммунологический профиль, который способствует ответу на иммунотерапию, а также определить прогностические маркеры ответа и резистентности.
Это помогает определить, какие подмножества опухолей имеют молекулярный и иммунологический профиль, который способствует ответу на иммунотерапию, а также определить прогностические маркеры ответа и резистентности.
Первым важным достижением стало введение методов геномного анализа, которые позволяют профилировать все несинонимичные мутации, существующие в образце опухоли, а затем делать выводы об общей мутационной нагрузке и неоантигенной нагрузке каждого поражения. Актуальность неоантигенной нагрузки при различных солидных опухолях является основным прогностическим фактором ответа на иммунотерапию.
Еще одним замечательным технологическим усовершенствованием стало введение платформ флуоресцентной микроскопии, которые позволяют проводить количественный и многопараметрический патологический анализ тканей. Эти инструменты позволяют патологам и иммунологам подсчитывать отдельные иммунные, стромальные или неопластические клетки в поражениях и понимать относительные топологические отношения в свете конкретных фенотипических и функциональных свойств каждого подмножества. Последняя разработка обеспечивает количественные средства для оценки ключевых прогностических параметров ответа на иммунотерапию, а также иммуноскоры и общий иммунный контекст для поражений до и после терапии.
Последняя разработка обеспечивает количественные средства для оценки ключевых прогностических параметров ответа на иммунотерапию, а также иммуноскоры и общий иммунный контекст для поражений до и после терапии.
Дальнейшие трансляционные подходы, которые оказались ключевыми инструментами иммунологического исследования в контексте иммунотерапии, включают методы, которые позволяют измерять профили экспрессии генов в ткани, фиксированной формалином и залитой парафином (FFPE). Это позволяет понять, имеет ли конкретное поражение активную генную программу, связанную с иммунитетом.
Наконец, все существующие экспериментальные подходы, такие как мультипараметрическая проточная цитометрия и масс-цитометрия, которые позволяют0149 ex-vivo Анализ функции и антигенной специфичности Т-клеток, выделенных из хирургических образцов, помогает подтвердить потенциально релевантные неоантигены, на которые в каждом конкретном поражении нацелена иммунная система.
Jon Amund Kyte из Университетской больницы Осло, Норвегия, обсудил «Подходы к клеточной терапии и ранние клинические исследования».
Адоптивная клеточная терапия (АКТ) с инфильтрирующими опухоль лимфоцитами в терапии рака уже используется для лечения метастатической меланомы. Совсем недавно открылись современные технологии генной инженерии для перепрограммирования собственных Т-клеток пациента с помощью Т-клеточных рецепторов, нацеленных на опухоль (TCR), или химерных антигенных рецепторов (CAR). Затем эти Т-клетки превращаются в миллионы специфичных для опухоли «ракет» и возвращаются пациенту. Ряд исследований CAR Т-клеток продемонстрировал замечательные клинические ответы у пациентов с острым лимфобластным лейкозом, предварительно получавших интенсивное лечение (80–9).0% полных ответов), хронический лимфолейкоз или В-клеточные лимфомы. CAR представляют собой оптимизированные TCR, состоящие из переменной внеклеточного антигенсвязывающего одноцепочечного фрагмента (scFv) из моноклонального антитела (mAb) и сигнальных доменов из комплекса TCR. В отличие от TCR, CAR связывается HLA-независимым образом и может использоваться во всей популяции пациентов. В то время как CAR могут нацеливаться только на поверхностные антигены, TCR также распознают внутриклеточные антигены, что значительно расширяет спектр доступных мишеней. АКТ с перенаправленными Т-клетками еще не показала эффективности против солидных раков. В настоящее время изучается ряд подходов для устранения этого ограничения. Ключевые области исследований включают в себя попытки определить лучшие антигены-мишени, стратегии преодоления установившейся толерантности при солидных опухолях и подходы к персонализации терапии путем нацеливания на неоантигены, специфичные для пациента.
В то время как CAR могут нацеливаться только на поверхностные антигены, TCR также распознают внутриклеточные антигены, что значительно расширяет спектр доступных мишеней. АКТ с перенаправленными Т-клетками еще не показала эффективности против солидных раков. В настоящее время изучается ряд подходов для устранения этого ограничения. Ключевые области исследований включают в себя попытки определить лучшие антигены-мишени, стратегии преодоления установившейся толерантности при солидных опухолях и подходы к персонализации терапии путем нацеливания на неоантигены, специфичные для пациента.
Кристиан Бланк из Института рака Нидерландов обсудил влияние иммунотерапии рака на клиническое лечение рака. Ингибиторы контрольных точек Т-клеток, такие как PD-1 и CTLA-4, проявляют клиническую активность при различных злокачественных новообразованиях человека. Инфузия аутологичных инфильтрирующих опухоль Т-клеток показала активность при меланоме, а также может иметь значение при ВПЧ-положительном раке. Также инфузия генно-модифицированных Т-клеток проявляет клиническую активность, в частности, при В-клеточных злокачественных опухолях. Важно понимать, что эти различные виды иммунотерапии устраняют различные «проблемы» в опухолево-иммунных взаимодействиях. Например, считается, что блокада PD-1 в первую очередь высвобождает активность пула Т-клеток, уже находящихся в опухоли. Напротив, считается, что в дополнение к возможному воздействию на участок опухоли блокада CTLA-4 усиливает опухолеспецифические Т-клеточные ответы. Наконец, генно-модифицированная Т-клеточная терапия предполагает, что эндогенного Т-клеточного компартмента недостаточно, и создание нового Т-клеточного компартмента является препятствием, которое необходимо преодолеть для достижения регрессии опухоли. Также возникает вопрос, какая терапия будет наиболее эффективной для конкретного пациента?
Также инфузия генно-модифицированных Т-клеток проявляет клиническую активность, в частности, при В-клеточных злокачественных опухолях. Важно понимать, что эти различные виды иммунотерапии устраняют различные «проблемы» в опухолево-иммунных взаимодействиях. Например, считается, что блокада PD-1 в первую очередь высвобождает активность пула Т-клеток, уже находящихся в опухоли. Напротив, считается, что в дополнение к возможному воздействию на участок опухоли блокада CTLA-4 усиливает опухолеспецифические Т-клеточные ответы. Наконец, генно-модифицированная Т-клеточная терапия предполагает, что эндогенного Т-клеточного компартмента недостаточно, и создание нового Т-клеточного компартмента является препятствием, которое необходимо преодолеть для достижения регрессии опухоли. Также возникает вопрос, какая терапия будет наиболее эффективной для конкретного пациента?
Доктор Бланк изложил основу для описания взаимодействия между раком и иммунной системой в отдельных случаях, и это — на основе анализов биомаркеров — может помочь предсказать, какой конкретный аспект взаимодействия рака и иммунной системы должен быть целью терапии. Эта иммунограмма рака основана на двух ключевых наблюдениях. Во-первых, результат взаимодействия рака и иммунитета основан на ряде в значительной степени не связанных между собой параметров, включая такие аспекты, как чужеродность опухоли и ряд механизмов ингибирования Т-клеток. Во-вторых, «значение» этих параметров сильно различается у разных пациентов. Например, в то время как у некоторых пациентов внутриопухолевое ингибирование опухолеспецифических Т-клеток будет единственным дефектом, который необходимо устранить, у других пациентов опухоль может быть просто недостаточно чужеродной, чтобы в первую очередь вызвать клинически значимый Т-клеточный ответ. Из-за этой многофакторной природы взаимодействия рака и иммунитета можно ожидать, что только комбинация анализов биомаркеров лучше всего покажет, какой аспект взаимодействия рака и иммунитета должен быть в центре внимания в отдельных случаях. В дополнение к описанию того, какие дефекты взаимодействия рака и иммунитета необходимо исправить, иммунограмма рака также может быть полезна для обсуждения того, в каких случаях данный вариант лечения может не понадобиться.
Эта иммунограмма рака основана на двух ключевых наблюдениях. Во-первых, результат взаимодействия рака и иммунитета основан на ряде в значительной степени не связанных между собой параметров, включая такие аспекты, как чужеродность опухоли и ряд механизмов ингибирования Т-клеток. Во-вторых, «значение» этих параметров сильно различается у разных пациентов. Например, в то время как у некоторых пациентов внутриопухолевое ингибирование опухолеспецифических Т-клеток будет единственным дефектом, который необходимо устранить, у других пациентов опухоль может быть просто недостаточно чужеродной, чтобы в первую очередь вызвать клинически значимый Т-клеточный ответ. Из-за этой многофакторной природы взаимодействия рака и иммунитета можно ожидать, что только комбинация анализов биомаркеров лучше всего покажет, какой аспект взаимодействия рака и иммунитета должен быть в центре внимания в отдельных случаях. В дополнение к описанию того, какие дефекты взаимодействия рака и иммунитета необходимо исправить, иммунограмма рака также может быть полезна для обсуждения того, в каких случаях данный вариант лечения может не понадобиться./126.jpg) В качестве клинически значимого примера, неясно, будет ли предпочтительнее комбинированная блокада PD-1 и CTLA-4 у пациентов с существующим опухолеспецифическим Т-клеточным ответом по сравнению с блокадой PD-1 одним агентом из-за токсичности, связанной с комбинированное лечение и очень значительные затраты на лечение иммунотерапией рака.
В качестве клинически значимого примера, неясно, будет ли предпочтительнее комбинированная блокада PD-1 и CTLA-4 у пациентов с существующим опухолеспецифическим Т-клеточным ответом по сравнению с блокадой PD-1 одним агентом из-за токсичности, связанной с комбинированное лечение и очень значительные затраты на лечение иммунотерапией рака.
Сессия 2: Клиническая иммунотерапия и комбинации
Первая презентация дня «Ингибиторы иммунных контрольных точек и комбинированные подходы: текущее состояние и перспективы на будущее» была сделана Паоло Асьерто из Национального института опухолей в Неаполе, Италия. До недавнего времени большинство иммунотерапевтических подходов, используемых для борьбы с раком, были неэффективными из-за способности опухоли уклоняться от иммунной атаки. Тем не менее, обширные исследования улучшили наше понимание иммунологии опухолей и позволили разработать новые методы лечения, которые могут использовать иммунную систему пациента и предотвращать иммунную утечку. За последние несколько лет, благодаря многочисленным клиническим испытаниям и практическому опыту, мы накопили большое количество доказательств относительно потенциала долгосрочной выживаемости при использовании иммунотерапевтических агентов при различных типах злокачественных новообразований [1].
За последние несколько лет, благодаря многочисленным клиническим испытаниям и практическому опыту, мы накопили большое количество доказательств относительно потенциала долгосрочной выживаемости при использовании иммунотерапевтических агентов при различных типах злокачественных новообразований [1].
В 2011 году одобрение ипилимумаба, моноклонального антитела против цитотоксического белка, ассоциированного с Т-лимфоцитами (CTLA)-4, для лечения метастатической меланомы стало первым шагом в новую эру иммунотерапии. Впоследствии многообещающие результаты по выживаемости были достигнуты с помощью антител против запрограммированной смерти (PD)-1 ниволумаб и пембролизумаб у пациентов с различными видами рака, включая меланому на поздних стадиях, включая немелкоклеточный рак легкого и почечно-клеточный рак. Эти и другие разрабатываемые иммунотерапевтические агенты были провозглашены потенциальным поворотным моментом в лечении рака.
Учитывая многочисленные существующие иммунные контрольные точки и многочисленные механизмы, используемые опухолями для ухода от иммунной системы, нацеливание на отдельные пути контрольных точек с использованием различных комбинированных подходов является привлекательной терапевтической стратегией с потенциалом дальнейшего усиления противоопухолевого иммунного ответа. Несколько клинических исследований показали, что комбинирование различных видов иммунотерапии может улучшить исходы и, скорее всего, даст дополнительные клинические преимущества по сравнению с монотерапией. Иммунотерапия также оценивается в сочетании с другими методами лечения, включая химиотерапию, таргетные агенты и облучение.
Несколько клинических исследований показали, что комбинирование различных видов иммунотерапии может улучшить исходы и, скорее всего, даст дополнительные клинические преимущества по сравнению с монотерапией. Иммунотерапия также оценивается в сочетании с другими методами лечения, включая химиотерапию, таргетные агенты и облучение.
Хотя основное внимание в исследованиях и основные достижения на сегодняшний день уделяется меланоме, иммунотерапия активно исследуется при многих других типах рака, в том числе при тех, где возможности лечения для пациентов ограничены. Проводимые в настоящее время и планируемые исследования должны помочь сделать преимущества этих новых иммунотерапевтических средств доступными для пациентов с широким спектром онкологических заболеваний.
Николь Рекерс, , Медицинский центр Маастрихтского университета, Нидерланды, выступила с презентацией на тему «Сочетание лучевой терапии и иммунотерапии рака: изменение парадигмы?»
Имеются убедительные доказательства того, что помимо прямого воздействия лучевая терапия (ЛТ) может инициировать иммунный ответ. Ранее мы показали, что добавление L19-IL2 к ЛТ способно резко усилить иммунный ответ и что эта комбинированная терапия приводит к длительному синергетическому противоопухолевому эффекту. Рекерс предположил, что опухолевые клетки вне поля облучения также будут уничтожены при таком комбинированном лечении (абскопальный эффект) и что опухоли не могут образоваться снова после повторного заражения вылеченных животных (эффект памяти). На самом деле РТ Л19-IL2 был способен вылечить 100% первичных опухолей и был связан с повышенным процентом Т-клеток CD8 внутри этих облученных опухолей. При сочетании однократной лучевой терапии в дозе 15 Гр с L19-IL2 было излечено 20% необлученных вторичных опухолей. Интересно, что в необлученных опухолях мышей, получавших 15 Гр L19-IL2, наблюдалось значительное (p < 0,01) увеличение процента Т-клеток CD4 по сравнению с облученными опухолями. Фракционная лучевая терапия в сочетании с L19-IL2 вызывала значительную (p < 0,01) задержку роста необлученных опухолей, однако вторичные опухоли не излечивались.
Ранее мы показали, что добавление L19-IL2 к ЛТ способно резко усилить иммунный ответ и что эта комбинированная терапия приводит к длительному синергетическому противоопухолевому эффекту. Рекерс предположил, что опухолевые клетки вне поля облучения также будут уничтожены при таком комбинированном лечении (абскопальный эффект) и что опухоли не могут образоваться снова после повторного заражения вылеченных животных (эффект памяти). На самом деле РТ Л19-IL2 был способен вылечить 100% первичных опухолей и был связан с повышенным процентом Т-клеток CD8 внутри этих облученных опухолей. При сочетании однократной лучевой терапии в дозе 15 Гр с L19-IL2 было излечено 20% необлученных вторичных опухолей. Интересно, что в необлученных опухолях мышей, получавших 15 Гр L19-IL2, наблюдалось значительное (p < 0,01) увеличение процента Т-клеток CD4 по сравнению с облученными опухолями. Фракционная лучевая терапия в сочетании с L19-IL2 вызывала значительную (p < 0,01) задержку роста необлученных опухолей, однако вторичные опухоли не излечивались. Иммунологический анализ выявил увеличение экспрессии PD-1 на Т-клетках, инфильтрирующих эти опухоли, что свидетельствует о более регуляторном фенотипе после фракционированной лучевой терапии по сравнению с однократной лучевой терапией. Кроме того, было замечено, что у вылеченных мышей новые опухоли C51 не могли образовываться, тогда как у 100% контрольных мышей того же возраста формировались опухоли, которые достигали установленных конечных точек в течение 17 дней. Т-клетки селезенки этих вылеченных мышей были связаны с высокой экспрессией CD127, рецептора, связанного с потенциалом памяти.
Иммунологический анализ выявил увеличение экспрессии PD-1 на Т-клетках, инфильтрирующих эти опухоли, что свидетельствует о более регуляторном фенотипе после фракционированной лучевой терапии по сравнению с однократной лучевой терапией. Кроме того, было замечено, что у вылеченных мышей новые опухоли C51 не могли образовываться, тогда как у 100% контрольных мышей того же возраста формировались опухоли, которые достигали установленных конечных точек в течение 17 дней. Т-клетки селезенки этих вылеченных мышей были связаны с высокой экспрессией CD127, рецептора, связанного с потенциалом памяти.
В заключение данные показывают, что RT L19-IL2 вызывает противоопухолевый иммунный эффект также вне поля излучения, и что этот эффект связан с увеличением CD4 Т-клеток. Вылеченные мыши не могли образовывать новые опухоли и имели высокую экспрессию CD127 на своих Т-клетках, что позволяет предположить, что эти клетки обладают иммунологической памятью. Это новое лечение будет дополнительно изучено в исследовании фазы I для пациентов с олигометастатической солидной опухолью (NCT02086721).
«Вакцины против рака: все еще жизнеспособный подход?»0081 Доклад Пера Стратена (Копенгагенский университет). Он обсудил требования к созданию этой вакцины, различия в профилактических и терапевтических вакцинациях и связанные с ними иммунные реакции, как и почему раковые клетки становятся мишенями и распознаются антигены. Пара примеров испытаний вакцины, включая краткий обзор одобренных FDA/EMA клеток Sipuleu T, обсуждалась вместе с характером клинических ответов на вакцинацию — и, исходя из этого, — некоторые слайды обсуждения того, является ли терапевтическая вакцинация против рака все еще актуальной. (если это когда-либо было…) жизнеспособный подход….
Наконец, доклад «Влияние современной иммунотерапии на организацию медицинской помощи в онкологических центрах» представил Ahmad Awada (Institut Jules Bordet, Бельгия).
Это важное терапевтическое развитие современной иммунотерапии, несомненно, повлияет на организацию здравоохранения в онкологических центрах.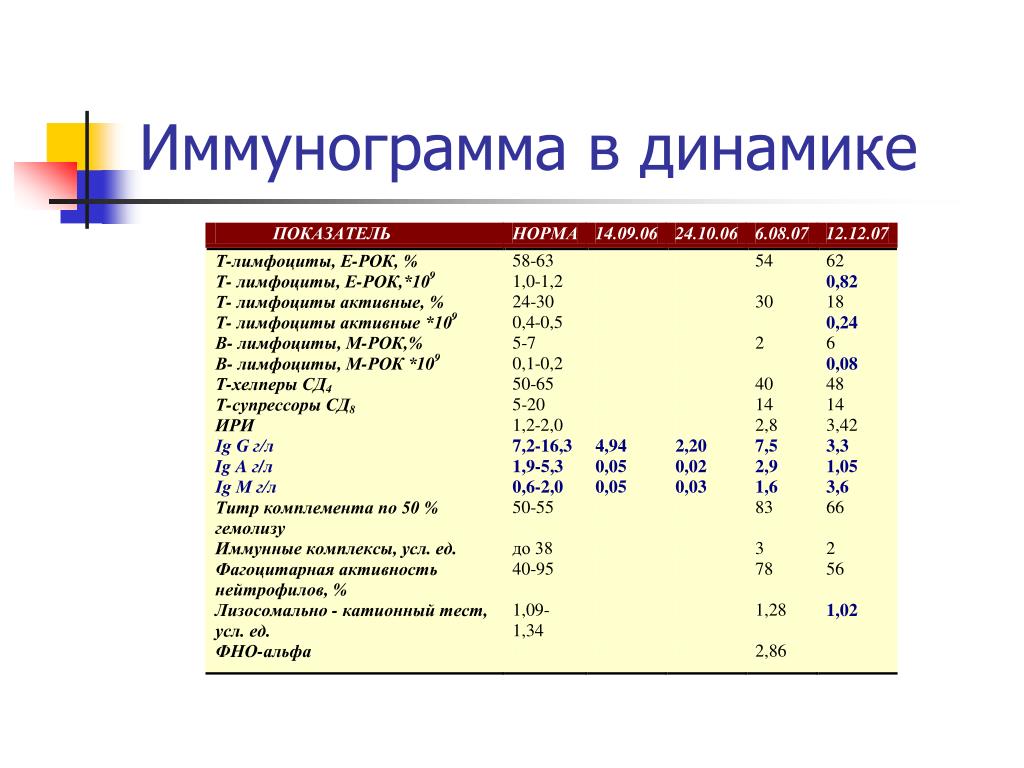 Д-р Авада обсудил причины этого, и они кратко изложены ниже:
Д-р Авада обсудил причины этого, и они кратко изложены ниже:
• Потенциально больше пациентов выживут после рака. Онкологические центры должны оптимально решать медицинские проблемы выживших.
• Увеличится число пациентов, длительно лечащихся в амбулаторных клиниках.
• Будут разработаны прогностические маркеры чувствительности/резистентности. Отделения патологии и молекулярной биологии должны следовать и внедрять эти достижения.
• Современная иммунотерапия будет иметь несколько нежелательных явлений, связанных с органами. Для борьбы с этими нежелательными явлениями необходим мультидисциплинарный подход (включая врачей-онкологов и специалистов по внутренним болезням).
• Разрабатываются методы адаптивной клеточной терапии. Эти подходы смогут реализовать только специализированные онкологические институты и университетские центры.
• Иммунотерапия эффективна почти при всех солидных и некоторых гематологических злокачественных новообразованиях.


