Содержание
Компоненты вакцины | Здоровье.мил
Дом МХС
Поиск по всему сайту
Нужен крупный текст?
- Медицинская готовность и боевое обеспечение
Отдел санитарного надзора вооруженных сил
Система медицинской экспертизы вооруженных сил
Программа крови для вооруженных сил
Гражданская военная медицина
Воздействие окружающей среды
Участие в глобальном здравоохранении
Отдел иммунизации здравоохранения
Вакциноуправляемые заболевания
Безопасность вакцины/нежелательные явления
Хранение вакцины и обращение с ней
Набор инструментов для иммунизации
Системы отслеживания иммунизации
Рекомендации по вакцинам
Образование и обучение
Клинические консультационные услуги
право
Руководство по освобождению от иммунизации
Информация о беременности
Основы иммунологии
Типы вакцин
Компоненты вакцины
Клинические исследования
Процесс непрерывного улучшения качества иммунизации (CQIIP) и Виртуальный процесс непрерывного улучшения качества иммунизации (VCQIIP)
Свяжитесь с Отделом иммунизации здравоохранения
Медицинская логистика
Здравоохранение
Вакцины содержат антигены, побуждающие организм вырабатывать антитела. Антитела борются с микробами, вызывающими заболевание, для предотвращения которого предназначена вакцина. В дополнение к антигенам вакцины содержат другие ингредиенты или добавки, используемые в процессе производства. Эти дополнительные ингредиенты используются для очистки, стабилизации и сохранения, повышения эффективности вакцин и/или создания вакцины.
Антитела борются с микробами, вызывающими заболевание, для предотвращения которого предназначена вакцина. В дополнение к антигенам вакцины содержат другие ингредиенты или добавки, используемые в процессе производства. Эти дополнительные ингредиенты используются для очистки, стабилизации и сохранения, повышения эффективности вакцин и/или создания вакцины.
Тимеросал
Тимеросал — консервант, препятствующий размножению бактерий. Тимеросал широко используется с 1930-х годов (более 75 лет) в вакцинах и других лекарствах для предотвращения заражения вредными бактериями и грибками.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает небольшое количество тимеросала в некоторых вакцинах приемлемо безопасным.
Тимеросал содержит ртуть. Если бы вы взвесили молекулу тимеросала, примерно половину ее веса составила бы ртуть. Ртуть в тимеросале находится в форме, называемой этилртутью. Это отличается от другой формы ртути, называемой метилртутью.
Высокий уровень метилртути в организме может повредить почки или нервную ткань. Люди подвергаются воздействию метилртути, когда едят определенные виды рыбы или морепродуктов.
С другой стороны, человеческий организм выводит («выводит») этилртуть быстрее, чем метилртуть. Благодаря этому этилртуть не накапливается в организме, что снижает ее способность причинять вред. Если бы существовала какая-либо теоретическая опасность от тимеросала, она относилась бы к маленьким детям и беременным женщинам, но не к людям с большей массой тела (например, детям старшего возраста и взрослым).
Несмотря на то, что существует мало доказательств того, что тимеросал может быть вредным, производители вакцин в США либо уменьшили количество тимеросала, либо удалили его из детских вакцин. Это решение было принято, чтобы сделать вакцины максимально безопасными.
Очень немногие вакцины по-прежнему содержат тимеросал в качестве консерванта. Список содержания тимеросала в некоторых американских вакцинах можно получить в Институте безопасности вакцин.
В развивающихся странах вакцины, содержащие тимеросал, по-прежнему широко используются, поскольку вакцины, не содержащие тимеросал, зачастую дороже.
Многочисленные популяционные исследования не выявили связи между иммунизацией вакцинами, содержащими тимеросал, и конкретными нарушениями развития нервной системы (например, аутизмом, задержкой речи или языка, синдромом дефицита внимания).
Иммунизация вакцинами, содержащими тимеросал, по-прежнему обеспечивает полную ценность вакцины без какого-либо измеримого риска, связанного с ртутью. Преимущества иммунизации намного перевешивают любые потенциальные риски от воздействия вакцин, содержащих тимеросал, по взвешенному мнению как FDA, так и Центров по контролю и профилактике заболеваний (CDC).
Комитет по обзору безопасности иммунизации Медицинского института (независимый комитет, состоящий из врачей-экспертов и ученых) недавно опубликовал отчет «Вакцины и аутизм», в котором сделан вывод: «Совокупность эпидемиологических данных свидетельствует в пользу отрицания причинно-следственной связи между вакцинами, содержащими тимеросал, и аутизм».
В четырех крупных исследованиях сравнивали риск развития аутизма у детей, получавших вакцины, содержащие тимеросал, и у детей, получавших вакцины без тимеросала. В каждом исследовании не было обнаружено связи между воздействием тимеросала и аутизмом или другими нарушениями развития нервной системы (НДР). Эти исследования ясны, последовательны и воспроизводимы и показывают, что воздействие тимеросала через детские вакцины не вызывает аутизм или NDD. Единственным свидетельством вреда, причиняемого тимеросалом, является небольшой риск аллергии, кожной сыпи или припухлости в месте инъекции, подобно другим вакцинам.
| Суспензия |
|
| Консерванты и стабилизаторы | Вещества, обеспечивающие содержание и эффективность вакцины, остаются неизменными. Общие консерванты и стабилизаторы включают: Общие консерванты и стабилизаторы включают:
|
| Адъюванты | Вещества, используемые для повышения эффективности вакцин. Алюминий является наиболее распространенным адъювантом, используемым в лицензированных в США вакцинах. |
| Остаточные материалы | Материалы, используемые для выращивания вируса или бактерий, содержащихся в вакцинах. Общие остаточные материалы включают:
|
Полные перечни компонентов вакцин, характерных для каждой вакцины, доступны по адресу: Институт безопасности вакцин Университета Джонса Хопкинса
Ссылки
- Offit PA, Jew RK. Решение проблем родителей: содержат ли вакцины вредные консерванты, адъюванты, добавки или остаточные вещества? Педиатрия. 2003 декабрь; 112 (6 часть 1): 1394-7
- CDC, Информационный бюллетень об ингредиентах вакцин
- Все (2)
- Публикации (1)
- Политика (1)
Заявление о компонентах вакцины против гриппа
Публикация
18. 10.2016
10.2016
Рекомендуемый контент:
Компоненты вакцины
Руководство Министерства обороны относительно вакцин, содержащих тиомерсал
Политика
Эта памятка содержит рекомендации по использованию вакцин, содержащих тимеросал.
- Идентификационный номер: Политика HA: 08-013
- Дата: 29.09.2008
- Тип: направляющие
- Темы:
Отдел иммунизации здравоохранения | грипп, Северное полушарие | Компоненты вакцины
Показаны результаты 1–2
Страница 1 из 1
Вы покидаете Health.mil
Появление гиперссылок не означает одобрения Министерством обороны сайтов, не принадлежащих правительству США, или содержащейся на них информации, продуктов или услуг. Хотя Агентство Министерства обороны США может использовать или не использовать эти сайты в качестве дополнительных каналов распространения информации Министерства обороны, оно не осуществляет редакционный контроль над всей информацией, которую вы можете найти на этих сайтах. Такие ссылки предоставляются в соответствии с заявленной целью этого веб-сайта.
Такие ссылки предоставляются в соответствии с заявленной целью этого веб-сайта.
Вы покидаете Health.mil
Просмотрите заявление об отказе от внешних ссылок.
Последнее обновление: 05 июня 2019 г.
Теоретический подход к разработке вакцины против ВИЧ
Этот подход к разработке вакцины против ВИЧ основан на теории и включает понимание иммунного ответа на ВИЧ-инфекцию и поиск способов создания и усиления этого ответа посредством вакцинации. Некоторые стратегии направлены на предотвращение заражения ВИЧ через антитела, в то время как другие направлены на создание защитного клеточного ответа.
Разработка вакцины против ВИЧ на основе антител
Ни у кого из ВИЧ-инфицированных никогда не развивался иммунный ответ, который излечивал бы инфекцию, поэтому ученые пока не знают, что представляет собой эффективный иммунный ответ на вирус.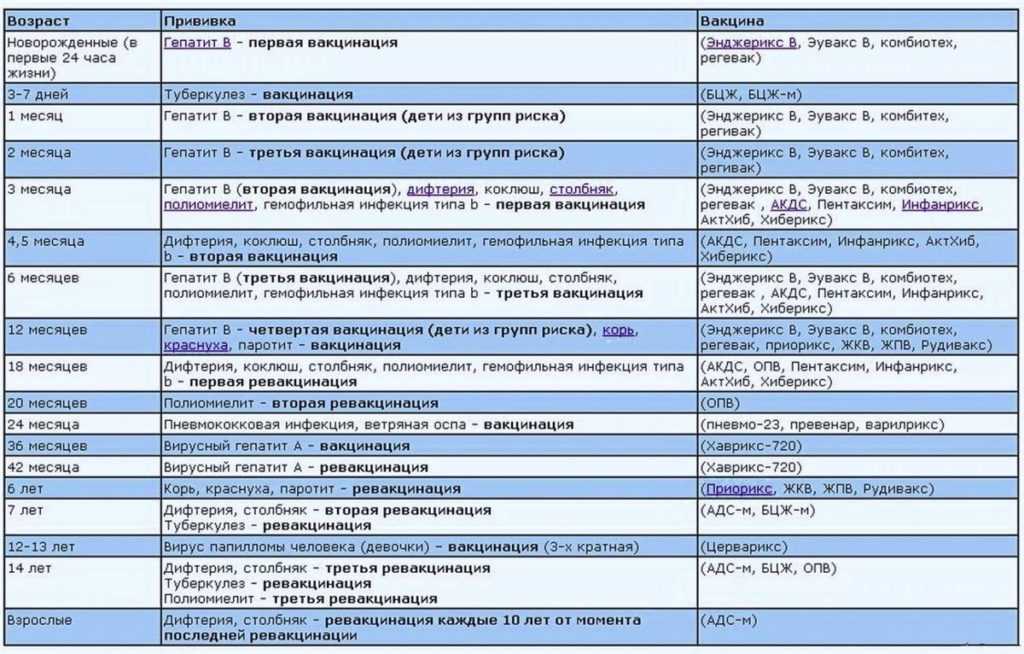 Однако исследователи заметили, что у некоторых людей, живущих с ВИЧ, через месяцы или годы после заражения естественным образом вырабатываются нейтрализующие антитела широкого спектра действия (bNAb) против вируса. В лаборатории было показано, что эти bNAb предотвращают инфицирование клеток человека большинством штаммов ВИЧ. Однако они не уничтожают вирус у людей, живущих с ВИЧ, поскольку к тому времени, когда bNAb появляется в зрелой форме, ВИЧ размножается и мутирует, избегая нейтрализации этим антителом. Но если бы вакцина могла генерировать bNAb у здоровых людей до контакта с ВИЧ, антитела потенциально могли бы полностью бороться с вирусом.
Однако исследователи заметили, что у некоторых людей, живущих с ВИЧ, через месяцы или годы после заражения естественным образом вырабатываются нейтрализующие антитела широкого спектра действия (bNAb) против вируса. В лаборатории было показано, что эти bNAb предотвращают инфицирование клеток человека большинством штаммов ВИЧ. Однако они не уничтожают вирус у людей, живущих с ВИЧ, поскольку к тому времени, когда bNAb появляется в зрелой форме, ВИЧ размножается и мутирует, избегая нейтрализации этим антителом. Но если бы вакцина могла генерировать bNAb у здоровых людей до контакта с ВИЧ, антитела потенциально могли бы полностью бороться с вирусом.
Многочисленные исследования, проведенные учеными NIAID, получателями грантов и другими лицами, предоставили доказательства того, что вакцина, вызывающая bNAb, может защитить людей от ВИЧ. Во-первых, исследователи показали, что введение bNAb обезьянам защищает их от заражения гибридным вирусом человека и обезьяны, подобным ВИЧ. Во-вторых, клинические исследования показали, что введение bNAb людям, живущим с ВИЧ, снижает количество вируса, циркулирующего в их крови. В-третьих, лабораторные исследования показали, что bNAb заметно подавляют выработку ВИЧ из инфицированных иммунных клеток, где вирус прячется в организме.
В-третьих, лабораторные исследования показали, что bNAb заметно подавляют выработку ВИЧ из инфицированных иммунных клеток, где вирус прячется в организме.
Для непосредственной проверки гипотезы о том, что bNAb могут предотвращать ВИЧ-инфекцию, весной 2016 года было запущено два крупных многонациональных клинических испытания, финансируемых NIAID, под названием AMP (антитело-опосредованная профилактика). взрослых с высоким риском заражения ВИЧ, чтобы узнать, защищает ли это их от вируса.
Одно из первых обнаруженных сильнодействующих bNAb, VRC01, было идентифицировано и выделено учеными Центра исследования вакцин NIAID (VRC) в 2010 г. С тех пор исследователи выделили сотни других bNAb, и многие ученые приступили к проекты по обратному проектированию вакцины против ВИЧ, которая вызывает одно из этих антител. Основной процесс включает в себя идентификацию участка, где bNAb связывается с вирусом, детальное описание молекулярной структуры этого участка, разработку белковой реплики участка связывания и тестирование реплики, называемой иммуногеном, на животных и людях, чтобы выяснить, он вызывает желаемый bNAb.
В 2018 году ученые VRC сообщили, что вакцина на основе гибридного пептида — уязвимого участка ВИЧ, который помогает вирусу слиться с клеткой для заражения — вызывала нейтрализующие антитела у мышей, морских свинок и обезьян. Ученые VRC впервые идентифицировали гибридный пептид-мишень в 2016 году и считают его особенно перспективным для использования в качестве вакцины, поскольку его последовательность одинакова для большинства штаммов ВИЧ, он экспонируется на шипе на поверхности ВИЧ, в нем отсутствуют сахара, которые скрывают иммунный ответ. система видит другие участки на внешней оболочке вируса, и иммунная система сильно на это реагирует. Экспериментальная вакцина включает часть слитого пептида, связанного с носителем, который вызывает сильный иммунный ответ. Этот иммуноген соединен с копией шипа на поверхности ВИЧ. Ученые работают над оптимизацией вакцины и в конечном итоге стремятся создать ее версию, пригодную для испытаний на безопасность на людях-добровольцах в рамках тщательно спланированных и контролируемых клинических испытаний.
Одной из характерных особенностей мощных bNAb против ВИЧ является то, что они мутируют десятки раз, прежде чем достигнут своей зрелой формы для борьбы с ВИЧ. Это означает, что для получения таких антител с помощью вакцинации, вероятно, потребуется первоначальная вакцина для запуска развития bNAb с последующей серией вакцинаций, чтобы уговорить bNAb двигаться по желаемому пути развития. Исследование генетики антител под руководством VRC в 2011 году позволило ученым сделать вывод о пошаговой эволюции VRC01 и родственных антител. Более того, исследования, проведенные учеными VRC и грантополучателями NIAID, показали, как bNAb и ВИЧ стимулируют эволюцию друг друга, проливая свет на необходимые структуры начальных и промежуточных иммуногенов схемы вакцинации против ВИЧ, которые будут генерировать зарождающиеся bNAb и способствовать их созреванию. Три исследования на животных, проведенные в 2015 году получателями грантов NIAID, предоставили доказательства того, что такая стратегия может вызвать желаемый ответ антител.
Родственный подход к созданию вакцины против ВИЧ заключается в получении множества антител к ВИЧ, каждое из которых нейтрализует лишь небольшое разнообразие штаммов ВИЧ, но вместе нейтрализует широкий спектр. Эта стратегия привлекательна, потому что некоторые умеренно нейтрализующие антитела имеют гораздо более короткий путь развития, чем bNAb, поэтому требуется гораздо меньше иммуногенов.
Понимание структуры ВИЧ
BNAb связываются в основном с пятью неизменяющимися участками, расположенными на шипах на поверхности ВИЧ. Эти шипы известны как гликопротеин оболочки, или Env. Каждый шип состоит из трех идентичных пар белков, которые в совокупности называются тримером. Во многих попытках иммунизации против ВИЧ использовался только один сегмент тримера, что давало субоптимальные результаты. В конце концов стало ясно, что весь тример будет более эффективным иммуногеном. Однако Env чрезвычайно трудно стабилизировать как автономную молекулу, отдельную от ВИЧ. Таким образом, в 2013 году грантополучатели NIAID разработали более стабильную форму Env и получили ее изображение на атомарном уровне.
В следующем году исследование, проведенное совместно с учеными Национального института здоровья, обнаружило, что вакцина против ВИЧ, которая учит иммунную систему нейтрализовывать вирус, должна основываться на конфигурации, которую Env принимает перед слиянием с клеткой. Исследователи VRC создали структурную модель этого вирусного шипа до слияния с высоким разрешением, ценный инструмент для дизайна иммуногена ВИЧ. Дальнейшие исследования грантополучателей NIAID показали, что можно иммунизировать животных тримерными белками ВИЧ и модифицировать иммуногены Env, чтобы они стимулировали выработку самых ранних предшественников конкретных bNAb. Такие вакцины на основе экспериментальной структуры в настоящее время проходят раннюю стадию клинических испытаний в NIAID и других организациях.
Структурные исследования, проведенные учеными VRC, привели к открытию в 2016 году слитого пептида в качестве мишени для вакцины. Ученые подробно описали на атомарном уровне, как bNAb, выделенный из крови человека, живущего с ВИЧ, связывается с пептидом слияния и не дает вирусу заразить клетку. Эти идеи привели к разработке вакцины на основе слитых пептидов, которая может вызывать нейтрализующие антитела в моделях на животных.
Эти идеи привели к разработке вакцины на основе слитых пептидов, которая может вызывать нейтрализующие антитела в моделях на животных.
Разработка клеточной вакцины против ВИЧ
Альтернативный теоретический подход к разработке вакцины против ВИЧ направлен на получение мощного клеточного иммунного ответа, а не ответа антител. Некоторые грантополучатели NIAID, придерживающиеся этой стратегии, стремятся вызвать клеточный иммунный ответ на наиболее статичные области белков ВИЧ, создавая компоненты вакцины, ориентированные исключительно на эти области. Напротив, другие грантополучатели стремятся вызвать клеточный иммунный ответ, используя так называемые мозаичные антигены, которые представляют собой компьютерно-выведенные белки, созданные путем сшивания генетических последовательностей всего генома ВИЧ.
Приняв другой подход, другой грантополучатель NIAID, занимающийся клеточным ответом на ВИЧ, создал иммуноген, поместив выбранные гены ВИЧ в неродственный вирус, называемый цитомегаловирусом (ЦМВ).

 Остаточное количество после производства также полезно для предотвращения роста бактерий во время хранения вакцины.
Остаточное количество после производства также полезно для предотвращения роста бактерий во время хранения вакцины.