Содержание
Прививка акдс — что это такое и какие побочные эффекты
Корзина
0 ₽
Корзина
0 ₽
Дата публикации: 26.08.2020
ДетскиеДетские ватные палочкиДля детейДля новорожденныхЖаропонижающие для детейЖаропонижающие сиропыИнгаляторы детскиеКлеенки детскиеКолики у новорожденныхМочеприемники детскиеСредства при прорезывании зубовТермометры детские
Автор статьи
Гришина Александра Николаевна,
Врач-терапевт
Все авторы
Содержание статьи
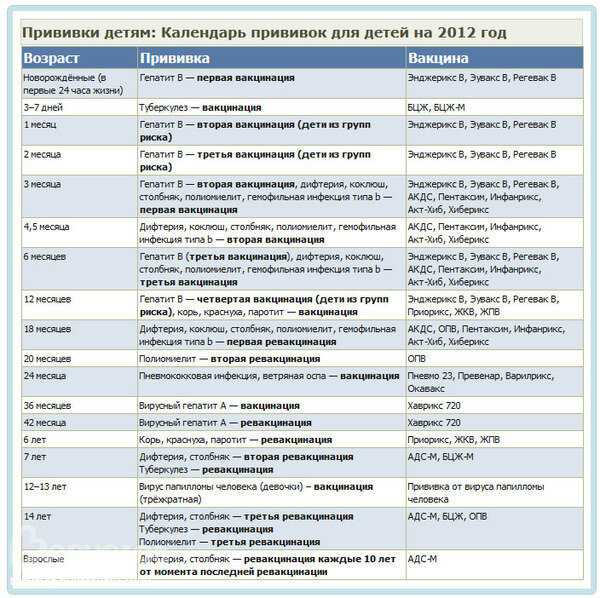
- Прививку АКДС от чего делают?
- Прививка АКДС — что это такое?
- Прививку АКДС когда делают?
- Прививка АКДС, побочные эффекты
- Какие вакцины АКДС бывают
- АКДС или пентаксим, сравнительный анализ вакцин
- Какую вакцину лучше выбрать
- Что делать после прививки
- Чего нельзя делать после прививки АКДС
- Задайте вопрос эксперту по теме статьи
Прививку АКДС от чего делают?
АКДС – прививка, которая защищает сразу от трех опасных инфекционных заболеваний. Она считается основной для детей грудного возраста, однако переносится не очень легко. Родители могут сами выбирать какую вакцину колоть – российского или зарубежного производства, но в чем между ними разница и какая лучше, наверняка не знают.
Она считается основной для детей грудного возраста, однако переносится не очень легко. Родители могут сами выбирать какую вакцину колоть – российского или зарубежного производства, но в чем между ними разница и какая лучше, наверняка не знают.
АКДС расшифровывается как адсорбированная коклюшно-дифтерийно-столбнячная вакцина. Из расшифровки становится понятно, от чего она защищает.
Вакцина способствует формированию иммунитета от трех инфекционных болезней, которые встречаются как у взрослых, так и у детей – от столбняка, коклюша и дифтерии.
Почему так важно колоть АКДС? Болезни, от которых защищает прививка, приводят к тяжелым последствиям, высока вероятность летального исхода. Например, до введения обязательной вакцинации смертность от столбняка составляла 90%, от дифтерии – 25%. Хоть от коклюша дети умирают редко, однако болезнь имеет тяжелое течение, нередко приводит к осложнениям в виде бронхита, пневмонии, плеврита.
Нет времени читать длинные статьи? Подписывайтесь на нас в соцсетях: слушайте фоном видео и читайте короткие заметки о красоте и здоровье.

Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Прививка АКДС — что это такое?
Прививку АКДС когда делают?
Коклюш и дифтерия по праву считаются детскими заболеваниями, хотя иногда ими болеют и взрослые. Но именно дети младшего возраста тяжелее всего переносят болезнь, поэтому прививка АКДС делается грудничкам. Чем раньше будет завершен курс иммунизации, тем меньший риск заражения.
Ребенку делают 3 прививки АКДС, каждую последующую дозу вводят не ранее, чем через 1,5 месяца. Детям до 4-х лет укол делают в переднюю часть бедра, старше 4-х лет – в дельтовидную мышцу плеча.
Вам может быть интересно: Почему рождение ребенка не всегда в радость?
Необходимо строго придерживаться графика вакцинации, иначе не сформируется стойкий иммунитет.
Через год после введения третьей дозы проводится первая ревакцинация, в 6-7 лет – вторая, в 14 лет – третья. Взрослым необходимо проходить ревакцинацию АКДС каждые 10 лет, поскольку введенная вакцина защищает от болезней на 5-7 лет.
Вакцинация проводится АКДС вакциной, ревакцинация для детей в возрасте 4-6 лет – АДС-анатоксином, для детей старше 6 лет – АДС-М-анатоксином.
Препараты для ревакцинации не содержат коклюшного компонента, поэтому легче переносятся.
Прививка АКДС, побочные эффекты
Вакцинация – это стресс для организма, удар по иммунной системе, поэтому не исключены негативные реакции на АКДС. Чтобы избежать излишних волнений, необходимо знать, какие возможны побочные действия.
Бесклеточные вакцины оказывают более мягкое воздействие, поэтому не вызывают бурных реакций.
Наиболее частым осложнением вакцинации является повышение температуры тела. Чаще речь идет о субфебрилитете, реже температурные показатели достигают 38-39 ˚С. Температура на фоне введения АКДС держится не более трех суток, с легкостью сбивается жаропонижающими.
Легче всего переносится первая прививка, сделанная в 3 месяца. Каждая последующая АКДС переносится тяжелее. Самые выраженные реакции могут быть на третью прививку.
Самые выраженные реакции могут быть на третью прививку.
Помимо высокой температуры, возникают такие побочные эффекты:
- ухудшение аппетита
- слабость, сонливость
- болезненность в месте укола, тянущая боль, распространяющаяся на всю ногу
- фебрильные судороги
- образование шишки в месте инъекции (уплотнение исчезает самостоятельно в течение 1-2 месяцев)
- аллергические реакции в виде крапивницы, отека Квинке
Если высокая температура после прививки держится больше двух дней, необходимо обращаться в больницу. При судорогах или развитии тяжелой аллергической реакции необходимо срочно вызывать скорую помощь.
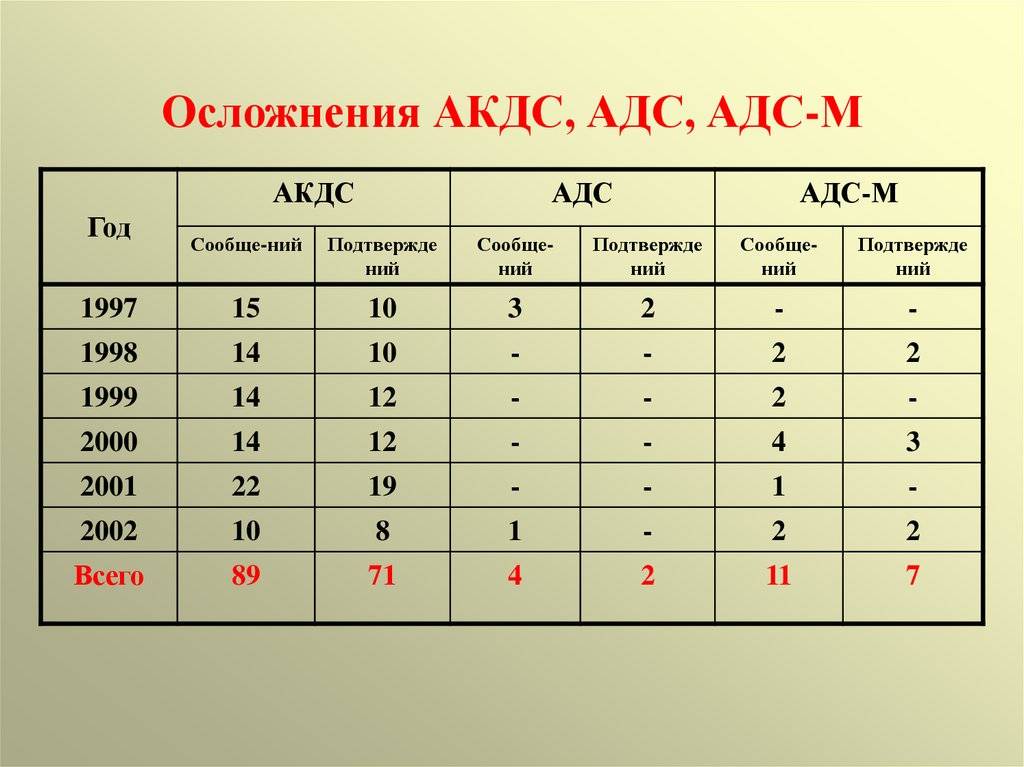
В 1% случаев использования цельноклеточной АКДС возникают осложнения:
- тяжелые аллергические реакции (анафилактический шок, отек Квинке)
- энцефалит, менингит
- синдром острой дыхательной недостаточности
- нарушение сердечного ритма
- снижение или повышение артериального давления
- судороги, парез
Появление поствакцинальных осложнений может быть связано не только с реакцией иммунной системы, но и с наличием противопоказаний к введению вакцины.
Какие вакцины АКДС бывают
Прививаться нужно обязательно, а вот какую вакцину выбрать? Основных три:
- АКДС. Это вакцина российского производства.
- Пентаксим. Комбинированная вакцина французского производства защищает сразу от пяти инфекционных заболеваний – столбняк, коклюш, дифтерия, полиомиелит и гемофильная инфекция (ХИБ).
- Инфанрикс. Это комбинированная вакцина от коклюша, столбняка и дифтерии бельгийского производства.
Отличаются эти вакцины не только страной-производителем и, конечно же, ценой, но и вирусной нагрузкой. Это и есть основной фактор, влияющий на выбор.
АКДС или пентаксим, сравнительный анализ вакцин
Пентаксим и АКДС в чем разница? В отличие от российской, зарубежные вакцины бесклеточные, они содержат только белок коклюшного микроорганизма. Благодаря этому они легче переносятся детьми, реже вызывают негативные реакции. Даже если взять Пентаксим, который одновременно защищает от 5, а не от 3 инфекционных болезней, то он оказывает более мягкое воздействие на организм, нежели АКДС.
Даже если взять Пентаксим, который одновременно защищает от 5, а не от 3 инфекционных болезней, то он оказывает более мягкое воздействие на организм, нежели АКДС.
Российская вакцина цельноклеточная, содержит мертвые клетки коклюшного компонента, который становится причиной поствакцинальных осложнений.
Какую вакцину лучше выбрать
При вакцинации зарубежными препаратами снижается вирусная нагрузка. У Инфанрикса она минимальная, всего 7 антигенов, у Пентаксима 26, а у АКДС – 3002.
Подсчет проводился исходя из следующего:
- цельноклеточный коклюшный компонент – 3 тыс. антигенов
- антигены коклюша в бесклеточной вакцине – 1-5 шт.
- полиомиелите – 15 шт.
- ХИБ – 2 шт.
- столбняка – 1 шт.
- дифтерии – 1 шт.
Вместе с антигенной нагрузкой снижается риск поствакцинальных осложнений. Но не уменьшается ли эффективность вакцинации?
С точки зрения формирования иммунитета к инфекционным болезням предпочтение отдают цельноклеточным вакцинам. Их эффективность достигает 100%, они обеспечивают более продолжительную защиту – до 5-7 лет. Однако вводимые антигены вызывают сильную реакцию организма, из-за этого количество противопоказаний и побочных действий больше.
Их эффективность достигает 100%, они обеспечивают более продолжительную защиту – до 5-7 лет. Однако вводимые антигены вызывают сильную реакцию организма, из-за этого количество противопоказаний и побочных действий больше.
Часто болеющим детям, малышам, в анамнезе которых есть аллергические заболевания, иммунодефицитные состояния, хронические болезни, рекомендуется введение бесклеточных вакцин. Они более безопасные, редко вызывают негативные реакции, формируют защиту на 4-6 лет, а иммуногенность (эффективность) составляет 83-100%.
Единственный недостаток зарубежных вакцин – их нужно покупать самостоятельно. Согласно Национальному календарю прививок бесплатно можно проходить вакцинацию только отечественной АКДС.
Что делать после прививки
Если ребенок подвержен аллергическим реакциям, то первые 30 минут необходимо находиться под медицинским наблюдением. Придя домой, лучше принять противоаллергическое средство и дать препарат из группы НПВС, например, Нурофен. Лекарство будет действовать не только как жаропонижающее, но и обезболивающее, поскольку первые сутки может сильно болеть нога. Первые 2-3 дня необходимо регулярно измерять температуру тела. Сбивать ее по необходимости.
Лекарство будет действовать не только как жаропонижающее, но и обезболивающее, поскольку первые сутки может сильно болеть нога. Первые 2-3 дня необходимо регулярно измерять температуру тела. Сбивать ее по необходимости.
При температуре выше 38˚С у грудничка нужно давать жаропонижающее, поскольку есть риск фебрильных судорог.
Что еще необходимо делать после АКДС? Важно придерживаться гипоаллергенного питания, употреблять больше жидкости.
Гулять на улице после АКДС можно, но только в тех местах, где нет людей. На фоне вакцинации снижается иммунитет, поэтому повышается вероятность респираторных заболеваний.
Если в месте инъекции появилась большая шишка, которая самостоятельно не уменьшается в течение 2-3 недель, можно делать компрессы с магнезией. Это ускорит рассасывание.
Чего нельзя делать после прививки АКДС
После вакцинации нельзя делать следующее:
- мочить место укола в первый день
- париться, принимать горячую ванну в первые 2-3 суток (лучше мыться под душем)
- перегреваться или переохлаждаться
- перекармливать ребенка
- вводить в рацион новую пищу
- употреблять продукты-аллергены
- гулять в местах большого скопления людей
Из-за поствакцинальных осложнений АКДС вызывает страх. Однако нужно включить здравый рассудок и понимать, что негативные реакции после введения вакцины можно предотвратить, а вот защититься от смертельно-опасных болезней иным способом нельзя!
Однако нужно включить здравый рассудок и понимать, что негативные реакции после введения вакцины можно предотвратить, а вот защититься от смертельно-опасных болезней иным способом нельзя!
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Копировать ссылку
Гид по аналогам за подписку
подпишитесь на соцсети и напишите в сообщения «аналоги»
Поделиться
Так ли страшна прививка АКДС?
История создания АКДС
Первая АКДС вакцина была зарегистрирована в 1949 году. Именно с нее во многих странах начал формироваться «Календарь профилактических прививок». Главная его задача —снизить детскую смертность и распространение инфекций, которые опасны для здоровья детей.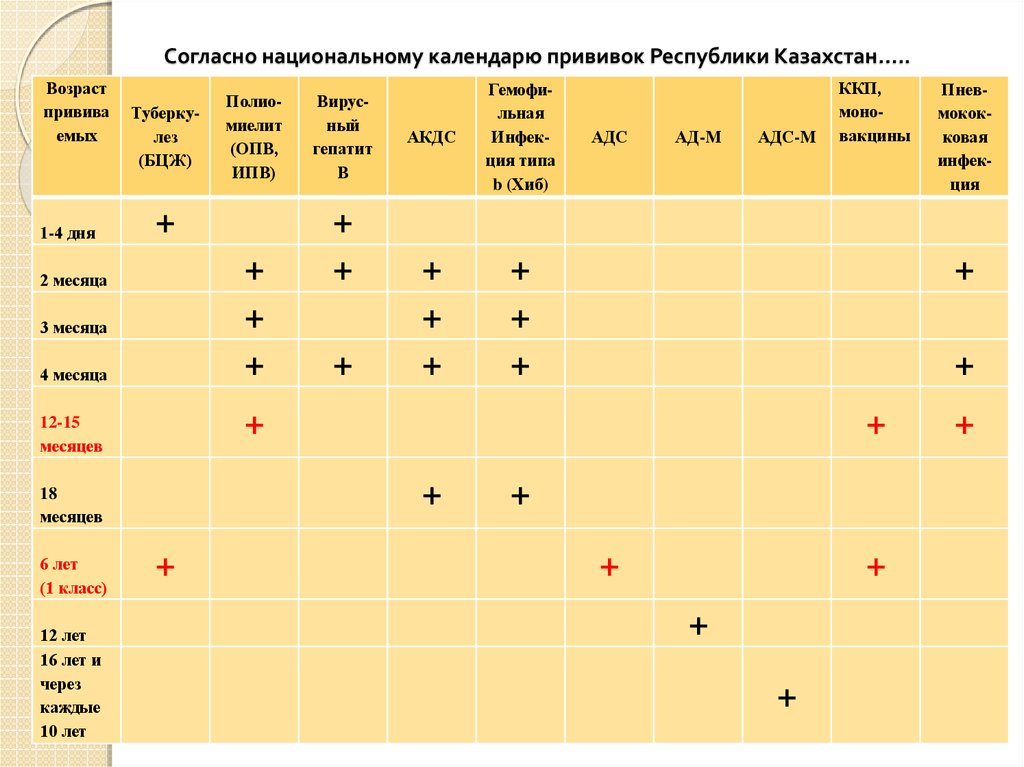 Коклюш в первой половине XX века, наряду с полиомиелитом и корью, был одной из самых распространенных детских инфекций. О полиомиелите мы рассказывали в одном из недавних материалов, вакцины против него создали в 50-х годах. От кори — примерно в это же время, а позднее ее объединили с вакцинами от паротита и краснухи в комбинированную — КПК.
Коклюш в первой половине XX века, наряду с полиомиелитом и корью, был одной из самых распространенных детских инфекций. О полиомиелите мы рассказывали в одном из недавних материалов, вакцины против него создали в 50-х годах. От кори — примерно в это же время, а позднее ее объединили с вакцинами от паротита и краснухи в комбинированную — КПК.
АКДС — это адсорбированная коклюшно-дифтерийно-столбнячная вакцина. Определение «адсорбированная» означает, что компоненты препарата выдержаны на веществах, которые усиливают действие и увеличивают продолжительность эффекта вакцинации. К таким веществам относится гидроксид алюминия и про него, как и про тиомерсал, которым пугают родителей, речь пойдет дальше, а пока вернемся к истории появления АКДС.
Статистика из архивов ЦГА НТД
Первая инактивированная (неживая) вакцина от коклюша была зарегистрирована в 1915 году. А 1923-1924 годах французский ученый Гастон Рамон разработал метод инактивации дифтерийного и столбнячного токсинов, который, с некоторыми изменениями, используется и сегодня. Тем не менее, ученым понадобилось еще более 20 лет, чтобы объединить и доработать эти открытия для создания комбинированной вакцины АКДС. И еще около 40 лет — на то, чтобы улучшить вакцину и исключить побочные действия, которые заслуженно или нет приписывают АКДС.
Тем не менее, ученым понадобилось еще более 20 лет, чтобы объединить и доработать эти открытия для создания комбинированной вакцины АКДС. И еще около 40 лет — на то, чтобы улучшить вакцину и исключить побочные действия, которые заслуженно или нет приписывают АКДС.
Чем опасны коклюш, дифтерия и столбняк и как их лечить?
Мы уже писали подробно о коклюше и дифтерии в материале «Болезни, которые возвращаются». Помимо прямых осложнений от этих инфекций? есть еще одна очень серьезная опасность: врачи, даже хорошие и опытные, настолько давно не сталкивались с этими болезнями, что не всегда могут их определить. Симптомы у этих инфекций на первом этапе достаточно схожи с другими заболеваниями. Учитывая, что при дифтерии или столбняке необходимо вводить антитоксин, любое промедление может оказаться фатальным.
Лечение антитоксином может иметь побочные эффекты и привести к аллергической реакции, близкой к анафилактическому шоку.
Специфического лекарства от коклюша, к сожалению, нет. Если врач вовремя выявит заболевание и в первые дни выпишет антибиотик определенной группы, это может снизить интенсивность протекания болезни, но не избавит от нее полностью. Более того, есть вероятность повторного заражения коклюшем через 3-12 лет. Естественный иммунитет, на который многие рассчитывают и ссылаются, далеко не всегда способен защитить.
Если врач вовремя выявит заболевание и в первые дни выпишет антибиотик определенной группы, это может снизить интенсивность протекания болезни, но не избавит от нее полностью. Более того, есть вероятность повторного заражения коклюшем через 3-12 лет. Естественный иммунитет, на который многие рассчитывают и ссылаются, далеко не всегда способен защитить.
Казахстан и статистика по отказам от АКДС
После распада СССР практически во всех постсоветских странах начались перебои с поставками вакцин, в частности — АКДС. Это привело к тому, что на территорию СНГ вернулись давно забытые детские инфекции, в числе которых были коклюш и дифтерия. Во второй половине 90-х в Казахстане наладили поставку вакцин АКДС и привили тех, кто пропустил вакцинацию.
Статистика предоставлена Комитетом санитарно-эпидемиологического контроля Министерства здравоохранения Казахстана
Памяти, не столько иммунной, сколько человеческой, хватило лет на 20.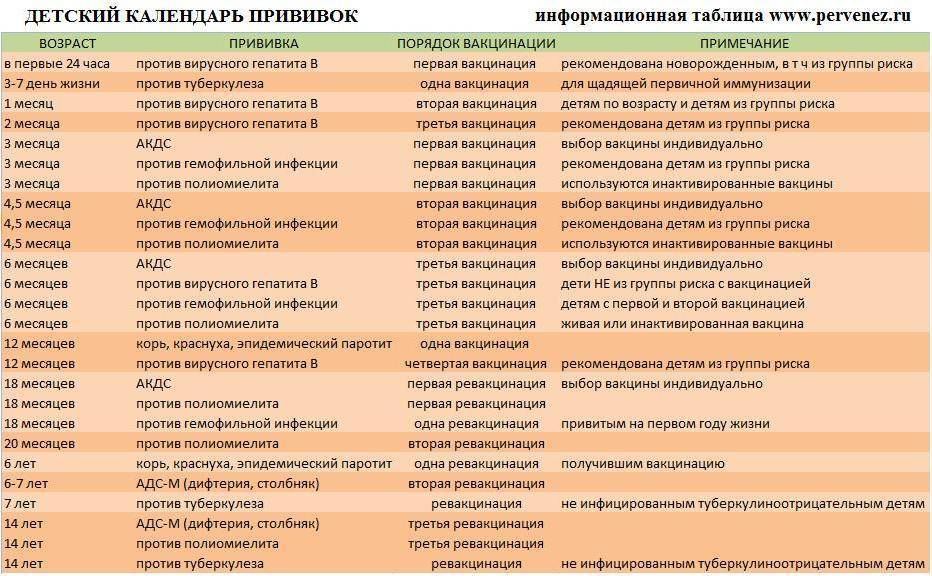 Сейчас вакцина АКДС лидирует по количеству отказов. Казахстанских родителей пугает вероятность неврологических осложнений, которые с 2013 года практически исключены благодаря использованию современной бесклеточной коклюшно-дифтерийной вакцины.
Сейчас вакцина АКДС лидирует по количеству отказов. Казахстанских родителей пугает вероятность неврологических осложнений, которые с 2013 года практически исключены благодаря использованию современной бесклеточной коклюшно-дифтерийной вакцины.
22 291 — это общее количество отказов от всех видов вакцин, не только АбКДС. Чтобы понять эти цифры, достаточно представить, что заявление на отказ от вакцинации обычно заполняется не на одну конкретную вакцину, а на несколько — например, АбКДС+Хиб+ВГВ+ИПВ и АбКДС+Хиб+ИПВ. Процентное соотношение по другим вакцинам мы разберем в следующих материалах.
Как боролись против АКДС в Америке и к чему это привело?
В 70-80-х годах прошлого века в Англии и США начались масштабные антипрививочные движения, главной мишенью которых была вакцина АКДС. Её обвиняли во многих детских недугах, родители подавали коллективные иски в суд и понадобились годы и масштабные исследования, чтобы доказать, что большая часть обвинений беспочвенна. Подробно, вплоть до расшифровок из зала судебного заседания, об этом рассказывает Пол Оффит в своей книге об истории вакцинации в Америке и Европе – «Смертельно опасный выбор».
Подробно, вплоть до расшифровок из зала судебного заседания, об этом рассказывает Пол Оффит в своей книге об истории вакцинации в Америке и Европе – «Смертельно опасный выбор».
Пол Оффит — практикующий педиатр, специалист по инфекционным болезням и вакцинам, иммунолог и вирусолог. Источник фото: montana.edu
Опасаясь возвращения в допрививочную эпоху, американское правительство утвердило законопроект, защищавший производителей вакцин, — «Национальный закон о компенсации пострадавшим от детских прививок», который уже через месяц, после подписи президента Рональда Рейгана, стал законом. В его основе была программа компенсаций пострадавшим, включая перечень вероятных осложнений после прививок. Главными задачами этого документа были: возможность получить компенсацию за осложнения после прививок, не проходя дорогостоящей процедуры подачи исков в суды штата; а также защитить фармацевтические компании от ответственности и подтолкнуть изготовителей вакцин к продолжению исследований и производству новых вакцин. Кроме того, закон создал механизм информирования родителей о безопасности вакцин — Систему регистрации побочного действия вакцин (Vaccine Adverse Events Reporting System, VAERS), благодаря которой доступны независимые обзоры вакцин и возможность сообщать о вероятных побочных эффектах.
Кроме того, закон создал механизм информирования родителей о безопасности вакцин — Систему регистрации побочного действия вакцин (Vaccine Adverse Events Reporting System, VAERS), благодаря которой доступны независимые обзоры вакцин и возможность сообщать о вероятных побочных эффектах.
Все это подтолкнуло не только американские, но и европейские фармкомпании к созданию более безопасной вакцины АКДС.
В чем разница между цельноклеточной и бесклеточной АКДС?
В первой половине XX века, когда появилась коклюшная вакцина, в ее составе использовалась целая клетка возбудителя коклюша. Она была инактивированная (убитая – прим V), но все же содержала около 3000 различных антигенов.
Среди 3000 антигенов и антигенно активных компонентов встречались и нейротоксичные, которые могли стать катализатором нежелательных эффектов в нервной системе ребёнка. Но не у всех и не всегда. Именно страх перед неврологическими осложнениями приводит к тому, что вакцина АКДС лидирует в списке по отказам в Казахстане, хотя эти опасения сейчас беспочвенны.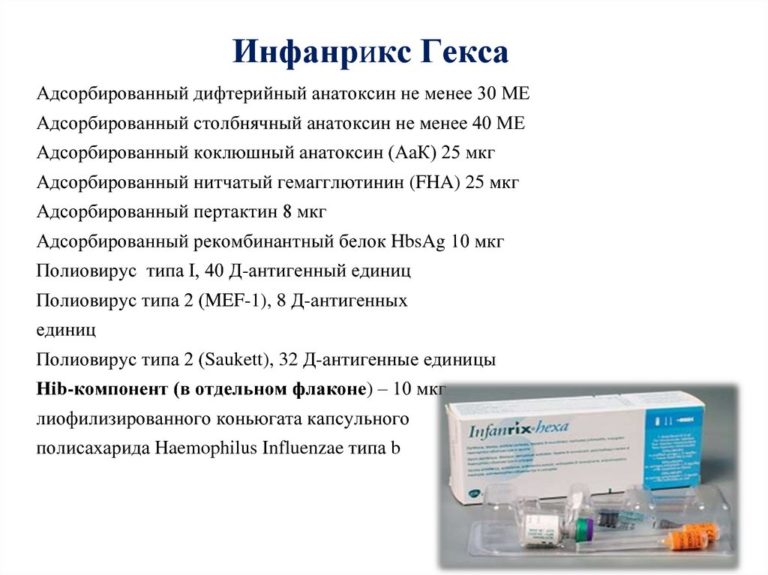
В 90-е годы XX века разработали более безопасный — бесклеточный вариант вакцины АКДС. Среди 3000 антигенов были определены 4 компонента, обладающих защитной активностью, и именно они стали основой нового варианта вакцины.
Коротко об основных различиях между новым поколением вакцин и предыдущим
Последний пункт о предполагаемом периоде защиты может стать и «обратной стороной» при переходе на бесклеточную вакцину АКДС. В Казахстане уже подрастает поколение, которое начали прививать АбКДС (вакциной с бесклеточным компонентом – прим. V). Сейчас им около 7-8 лет, значит, годом-двумя ранее они должны были пройти обязательную ревакцинацию в 6 лет. Этого иммунитета им хватит лет на 7, а дальше они уже могут быть не защищены от коклюша.
Учитывая, что охват коллективного иммунитета по факту ниже допустимого, иначе позабытые инфекции из прошлого не возвращались бы, то есть вероятность, что коклюш, как и другие заболевания, уже взрослеют. Это опасно не только для самих взрослых, но и для маленьких детей, которых они могут заражать, сами того не подозревая.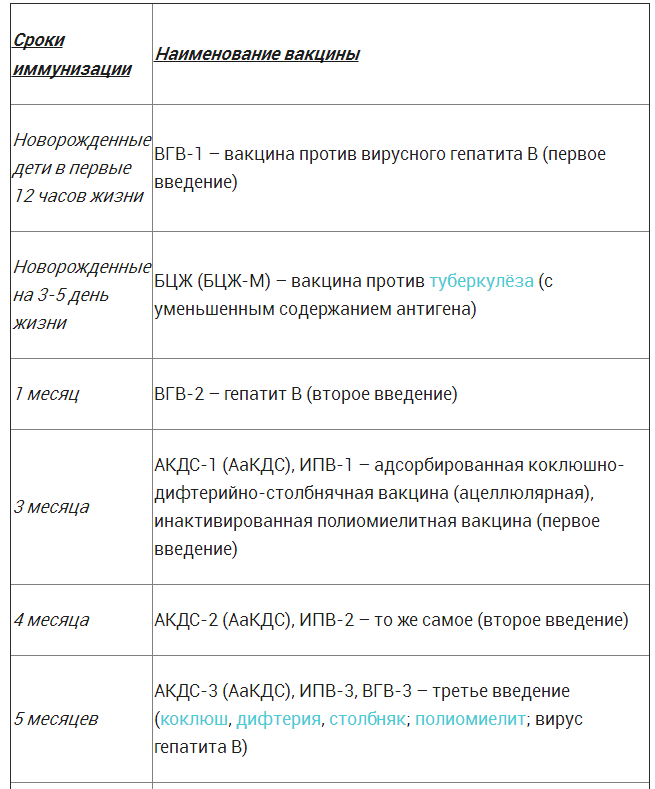 Для профилактики таких случаев во многих индустриальных странах, включая Австралию, Францию, Германию и США, практикуется «стратегия кокона». Она помогает защищать младенцев и других уязвимых лиц с помощью ревакцинации тех, кто находится с ними в тесном контакте. К примеру, если в семье ожидают малыша, то до его рождения все члены семьи должны получить прививку от коклюша, чтобы защитить ребенка в первые месяцы после рождения — до формирования собственного иммунитета.
Для профилактики таких случаев во многих индустриальных странах, включая Австралию, Францию, Германию и США, практикуется «стратегия кокона». Она помогает защищать младенцев и других уязвимых лиц с помощью ревакцинации тех, кто находится с ними в тесном контакте. К примеру, если в семье ожидают малыша, то до его рождения все члены семьи должны получить прививку от коклюша, чтобы защитить ребенка в первые месяцы после рождения — до формирования собственного иммунитета.
В Казахстане сейчас не зарегистрированы коклюшные вакцины для взрослых. Вопрос об их целесообразности будет рассматриваться не раньше 2022 года, когда завершится исследование «Серологический эпидназдор за антителами коклюша Бордетеллы среди здоровых детей и подростков в Казахстане». Такой ответ мы получили от Минздрава.
Какие вакцины используются в Казахстане?
В Казахстане для профилактики коклюша, дифтерии и столбняка используются вакцины трех разных производителей. В этом материале мы подробно разберем прививку «Гексаксим», с которой и начинается вакцинация АКДС в двухмесячном возрасте. В ее составе компоненты, защищающие от 6 инфекций (отсюда и название) — коклюша, дифтерии, столбняка, полиомиелита (всех 3-х типов), гемофильной палочки типа В и гепатита В. Многих родителей пугает то, что совсем маленьким детям ставят сразу 6-компонентную вакцину. Мы уже писали о безопасности современных комбинированных вакцин в материале про мифы вакцины КПК, но повторим самое главное. Первое — количество антигенов в современных комбинированных вакцинах минимально и не может нанести вред детскому организму, но его достаточно, чтобы вызвать иммунный ответ. Второе — такие вакцины позволяют минимизировать количество посещений больницы и при этом помогают защитить ребенка от многих серьезных инфекций и их осложнений.
В ее составе компоненты, защищающие от 6 инфекций (отсюда и название) — коклюша, дифтерии, столбняка, полиомиелита (всех 3-х типов), гемофильной палочки типа В и гепатита В. Многих родителей пугает то, что совсем маленьким детям ставят сразу 6-компонентную вакцину. Мы уже писали о безопасности современных комбинированных вакцин в материале про мифы вакцины КПК, но повторим самое главное. Первое — количество антигенов в современных комбинированных вакцинах минимально и не может нанести вред детскому организму, но его достаточно, чтобы вызвать иммунный ответ. Второе — такие вакцины позволяют минимизировать количество посещений больницы и при этом помогают защитить ребенка от многих серьезных инфекций и их осложнений.
В три месяца по календарю прививок идёт вакцина «Пентаксим» — она отличается тем, что в ее составе нет компонента, защищающего от гепатита В — эту инфекцию и вакцины от нее мы разберем в одном из ближайших материалов.
В инструкции производителя к вакцине «Гексаксим» написано, что ее возможно использовать для первичной иммунизации начиная с 6 недель, то есть у полуторамесячных младенцев. В Казахстане, напомним, она ставится детям с двух месяцев. Такой ранний срок обусловлен тем, что все перечисленные выше инфекции наиболее опасны в младенческом возрасте, так как могут привести к летальному исходу или инвалидности. Аналог вакцины «Гексаксим» — «Инфанрикс Гекса» бельгийского производителя GlaxoSmithKline Biologicals s.a.
В Казахстане, напомним, она ставится детям с двух месяцев. Такой ранний срок обусловлен тем, что все перечисленные выше инфекции наиболее опасны в младенческом возрасте, так как могут привести к летальному исходу или инвалидности. Аналог вакцины «Гексаксим» — «Инфанрикс Гекса» бельгийского производителя GlaxoSmithKline Biologicals s.a.
Что делать, если ребенок не получил АбКДС-содержащие вакцины в первые полтора года жизни?
До 7-летнего возраста: прививаются комбинированными АбКДС-содержащими вакцинами с повышенным содержанием дифтерийного анатоксина — 2 прививки с интервалом в 2 месяца. Третья прививка — через 6-12 месяцев. Вакцины — «Гексаксим» и «Пентаксим».
Старше 7 лет и взрослые: прививаются 2 прививками АбКДС с уменьшенным содержанием дифтерийного анатоксина с интервалом 1 месяц. Третья прививка — через 6-12 месяцев. Вакцина — «Бустрикс».
В 16 лет и далее каждые 10 лет: ревакцинация адсорбированной дифтерийно-столбнячной вакциной АДС-М.
Ртуть, алюминий и другие компоненты вакцины АКДС
Беспокоиться о составе вакцин — естественное право родителей маленьких детей и тех, кто вакцинируется во взрослом возрасте. Но важно понимать, что те заявления, которыми принято пугать во многих антипрививочных сообществах, зачастую вырваны из контекста и информация не приводится в полном объеме.
Но важно понимать, что те заявления, которыми принято пугать во многих антипрививочных сообществах, зачастую вырваны из контекста и информация не приводится в полном объеме.
Начнем с того, что ни в одной вакцине из казахстанского детского календаря ртути и соединений ртути нет. В этом можно убедиться, изучив состав вакцин на сайте Национального центра экспертизы лекарственных средств и медицинских изделий.
Второй важный факт: в вакцинах не используется ртуть в чистом виде, а тиомерсал — ртутьсодержащее химическое соединение. Его добавляют в состав вакцины как консервант, который предотвращает заражение жидкости вакцины различными бактериями и грибами, поддерживает стерильность препарата. Чаще всего консерванты добавляют в многодозовые вакцины, когда один флакон содержит несколько доз.
Когда тиомерсал попадает в организм, он разбивается на две части. Один из компонентов, который как раз и содержит ртуть, быстро выводится из организма. Научные данные, собранные за последние 15 лет, показали, что тиомерсал в вакцинах не приносит никакого вреда. Зарегистрированные побочные эффекты при его применении — боль и покраснение на месте инъекции.
Зарегистрированные побочные эффекты при его применении — боль и покраснение на месте инъекции.
Алюминий присутствует в вакцинах в виде гидроксида и солей: алюминия гидроксифосфата сульфат, фосфата алюминия, сульфата алюминия. Он используется как адъювант — химическое соединение, которое усиливает иммунный ответ организма на антиген в вакцине. Эффект алюминия, как адъюванта, был описан в 1926 году и используется во многих вакцинах по сей день.
Та концентрация соединений алюминия, что присутствует в вакцинах, сводит на нет риск развития нежелательных последствий — алюминий из вакцин практически не усваивается организмом, и, тем более, не влияет на мозг.
Таким образом, дети получают намного больше алюминия с питанием, чем с вакцинами, полученными в первые шесть месяцев их жизни. До 7 лет в составе всех вакцин ребенок получает примерно 3.6 мг гидроксида алюминия. Эта доза нетоксична даже при единовременном введении.
Противопоказания к АбКДС
Мы уже подробно разбирали тему противопоказаний, а также ложных медотводов.
Помимо перечисленных противопоказаний в инструкции к вакцине «Гексаксим» также есть пункт: «вакцины с содержанием коклюшного компонента нельзя вводить лицам с прогрессирующими неврологическими расстройствами и неконтролируемой эпилепсией до стабилизации состояния, при условии, когда польза от вакцинации значительно превышает риск». Это означает, что стабильные неврологические состояния, такие как ДЦП, синдром Дауна и непрогрессирующее течение эпилепсии, не являются противопоказаниями к вакцинации.
После — не значит вследствие
Эту парадигму хорошо иллюстрирует история из книги Пола Оффита «Смертельно опасный выбор»: «Один почетный профессор Медицинской школы университета Дьюка рассказывает историю о своем знакомом, который отвез сына к врачу делать прививку АКДС. Он очень долго прождал в очереди и в конце концов устал и поехал домой, так и не сделав ребенку прививку. Через несколько часов отец обнаружил ребенка мертвым в кроватке – видимо, малыш погиб от синдрома внезапной детской смерти. Только представьте себе, каково было бы отцу, если бы его сыну в тот день сделали прививку. Конечно, никакие исследования не убедили бы его, что ребенок погиб не от вакцины, а от каких-то других причин».
Только представьте себе, каково было бы отцу, если бы его сыну в тот день сделали прививку. Конечно, никакие исследования не убедили бы его, что ребенок погиб не от вакцины, а от каких-то других причин».
Авторы этого материала — тоже родители маленьких детей. И нам понятно отчаяние родителей, которые пытаются найти причину отклонений у ребенка в вакцине. Но это далеко не всегда так, и это доказано множеством статистических исследований в разных странах. Подобные исследования проводились не фармкомпаниями, а самими государствами, чтобы исключить предвзятость. Больше всего исследований приходится как раз на вакцину АКДС и коклюшный компонент, которого так боятся родители. Дети первого года жизни получают, в среднем, три дозы вакцины, в составе которой АКДС компоненты или АбКДС (б – бесклеточный коклюшный компонент, прим V). Большинство генетических заболеваний также проявляются в первый год-полтора жизни детей. Учитывая частоту вакцинации в этот период, достаточно заманчиво связать эти два события между собой.
Тем не менее, вакцины, как и другие медицинские препараты, могут в редких случаях приводить к осложнениям. Как их распознавать и регистрировать в Казахстане, мы разберем в одном из следующих материалов.
Сравнение вероятности осложнений от вакцин и болезней
В мире, где каждый, преимущественно, сам за себя, довод, что «те, кто не вакцинируются без видимых причин, ставят под угрозу других», работает плохо. Мы это понимаем. Поэтому, вместо заключения, мы перевели и дополнили таблицу, где приведена частота осложнений от вакцин и от болезней. Оригинал таблицы опубликован на сайте австралийского правительства в рамках Национальной программы иммунизации.
При подготовке этого материала мы использовали следующие источники:
Регистрация АКДС
Книга Пола Оффита «Смертельно опасный выбор. Чем борьба с прививками грозит нам всем»
ВОЗ о столбняке
CDC и тиомерсале
Приказ №361 от 13 июня 2018 года о «Санитарно-эпидемиологических требованиях по проведению профилактических прививок населению».
Алюминий и вакцины – влияние на младенцев
Сравнение осложнений от болезней и побочных эффектов от вакцин, подготовленное в рамках Национальной программы иммунизации Австралии
Количество антигенов в детских вакцинах
«Стратегия кокона» для защиты новорожденных от коклюша
CDC: данные о коклюше и вероятности заразиться им повторно
Авторы благодарят Томирис Муликову и команду Medsupportkz за помощь в подготовке материала
Мнения, выраженные в данном материале, принадлежат авторам и не обязательно отражают официальные точки зрения Представительства ЮНИСЕФ в Казахстане и Агентства США по международному развитию (USAID).
Исследования вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек ex vivo: неспособность защитить и возможное усиление провокационной инфекции четырьмя клеточными вакцинами, приготовленными с использованием аутологичных лимфобластов
1. Артур Л.О., Дж.В. Дж. Л. Россио, М. Т. Эссер, Р. Э. Бенвенист, Л. Э. Хендерсон и Дж. Д. Лифсон.
Т. Эссер, Р. Э. Бенвенист, Л. Э. Хендерсон и Дж. Д. Лифсон.
1998. Химическая инактивация ретровирусной инфекционности путем нацеливания на нуклеокапсидный белок цинковые пальцы: вакцина-кандидат против ВИО. СПИД рез. Гум. Ретровир.
14 : S311-S319. [PubMed] [Google Scholar]
2. Бинли, Дж. М., Р. В. Сандерс, Б. Клас, Н. Шуэльке, А. Мастер, Ю. Го, Ф. Каджумо, Д. Дж. Ансельма, П. Дж. Мэддон, У. К. Олсон и Дж. П. Мур.
2000. Рекомбинантный гликопротеиновый комплекс оболочки вируса иммунодефицита человека типа 1, стабилизированный межмолекулярной дисульфидной связью между субъединицами gp120 и gp41, представляет собой антигенный имитатор тримерной вирион-ассоциированной структуры. Дж. Вирол.
74 : 627-643. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Бишоп, С. А., К. Р. Стоукс, Т. Дж. Граффид-Джонс, К. В. Уайтинг, Дж. Э. Хамфрис, Р. Осборн, М. Папанастасопулу и Д. А. Харбор.
1996. Вакцинация клетками, инфицированными фиксированным вирусом иммунодефицита кошек (FIV): защита, прорыв и специфичность ответа.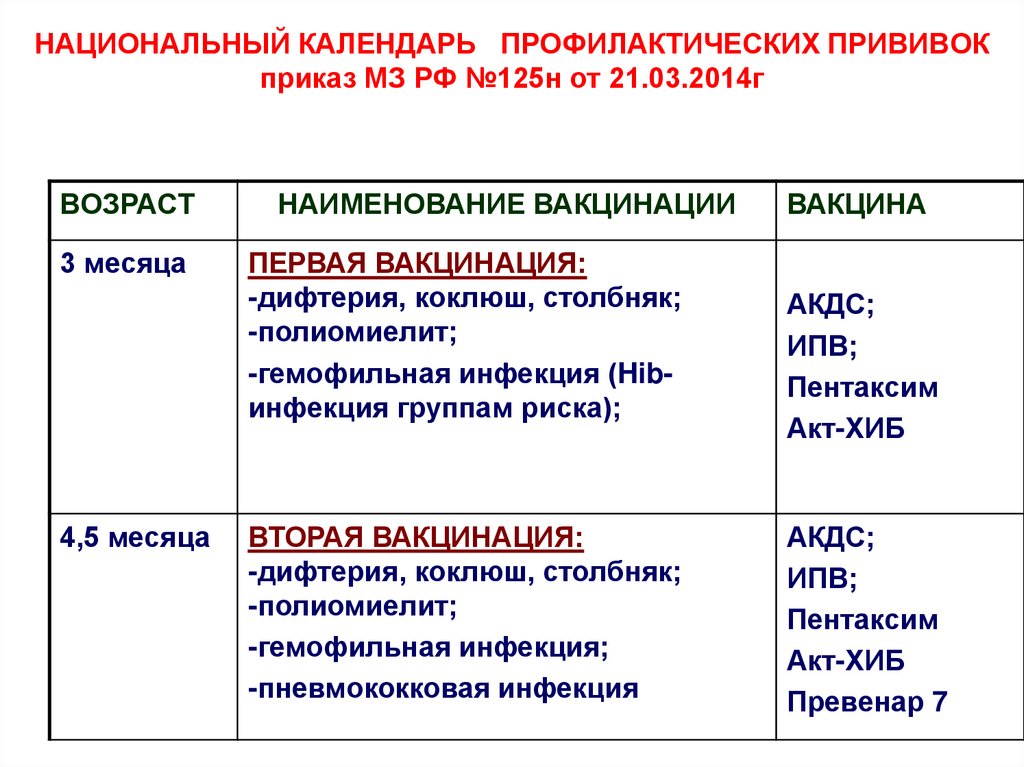 вакцина
вакцина
14 : 1243-1250. [PubMed] [Google Scholar]
4. Bogers, WMJM, C. Cheng-Mayer и RC Montelaro.
2000. Развитие доклинических моделей эффективности вакцин против СПИДа. СПИД
14 : S141-S151. [PubMed] [Google Scholar]
5. Burton, D. R., and P. W. H. I. Parren.
2000. Вакцины и индукция функциональных антител: время выйти за рамки молекул естественной инфекции? Нац. Мед.
6 : 123-125. [PubMed] [Google Scholar]
6. Каландрелла М., Д. Маттеуччи, П. Маццетти и А. Поли.
2001. Денситометрический анализ вестерн-блоттинга антител к вирусу иммунодефицита кошек. Вет. Иммунол. Иммунопатол.
79 : 261-271. [PubMed] [Google Scholar]
7. Чан, округ Колумбия, и П.С. Ким.
1998. Проникновение ВИЧ и его ингибирование. Клетка
93 : 681-684. [PubMed] [Google Scholar]
8. де Парсеваль А. и Дж. Х. Элдер.
Элдер.
2001. Связывание рекомбинантного поверхностного гликопротеина вируса иммунодефицита кошек с кошачьими клетками: роль CXCR4, гепаранов клеточной поверхности и неопознанного рецептора, отличного от CXCR4. Дж. Вирол.
75 : 4528-4539. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. de Rosny, E., R. Vassell, P.T. Wingfield, C.T. Wild и C.D. Weiss.
2001. Пептиды, соответствующие мотивам гептадных повторов в трансмембранном белке (gp41) вируса иммунодефицита человека типа 1, вызывают образование антител к активируемым рецептором конформациям оболочечного гликопротеина. Дж. Вирол.
75 : 8859-8863. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Доранц, Б.Дж., С.С.В. Байк и Р.В. Домс.
1999. Использование анализа связывания gp120 для анализа требований и кинетики событий слияния вируса иммунодефицита человека. Дж. Вирол.
73 : 10346-10358. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Edinger, A.L., M. Ahuja, T. Sung, KC Baxter, B. Haggarty, RW Doms и JA Hoxie.
Edinger, A.L., M. Ahuja, T. Sung, KC Baxter, B. Haggarty, RW Doms и JA Hoxie.
2000. Характеристика и картирование эпитопов нейтрализующих моноклональных антител, полученных путем иммунизации олигомерным белком оболочки вируса иммунодефицита обезьян. Дж. Вирол.
74 : 7922-7935. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Эгберинк, Х. Ф., Э. Де Клерк, А. Л. Ван Влит, Дж. Бальзарини, Г. Дж. Бриджер, Г. Хенсон, М. К. Хорзинек и Д. Шолс.
1999. Бицикламы, селективные антагонисты человеческого хемокинового рецептора CXCR4, сильно ингибируют репликацию вируса иммунодефицита кошек. Дж. Вирол.
73 : 6346-6352. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Elder, JH, G.A. Dean, EA Hoover, JA Hoxie, MH Malim, L. Mathes, JC Neil, TW North, E. Sparger, MB Tompkins, В. А. Ф. Томпкинс, Дж. Ямамото, Н. Юки, Н. К. Педерсен и Р. Х. Миллер.
1998. Урок от кошки: вирус иммунодефицита кошек как инструмент для разработки стратегии вмешательства против вируса иммунодефицита человека типа 1. AIDS Res. Гум. Ретровир.
AIDS Res. Гум. Ретровир.
14 : 797-801. [PubMed] [Google Scholar]
14. Элдер, Дж. Х. и Т. Р. Филлипс.
1995. Вирус иммунодефицита кошек как модель для разработки молекулярных подходов к стратегии вмешательства против лентивирусных инфекций. Доп. Вирус Рез.
45 : 225-247. [PubMed] [Google Scholar]
15. Эльяр, Дж. С., М. К. Телье, Дж. М. Сус и Дж. К. Ямамото.
1997. Перспективы разработки вакцины против FIV. вакцина
15 : 1437-1444. [PubMed] [Академия Google]
16. Финерти С., К. Р. Стоукс, Т. Дж. Грифид-Джонс, Т. Дж. Хиллман, Ф. Дж. Барр и Д. А. Харбор.
2001. Целенаправленная иммунизация лимфатических узлов может защитить кошек от заражения слизистых оболочек вирусом кошачьего иммунодефицита. вакцина
20 : 49-58. [PubMed] [Google Scholar]
17. Финнеган, К. М., В. Берг, Г. К. Льюис и А. Л. ДеВико.
2001. Антигенные свойства оболочки вируса иммунодефицита человека при слиянии клеток.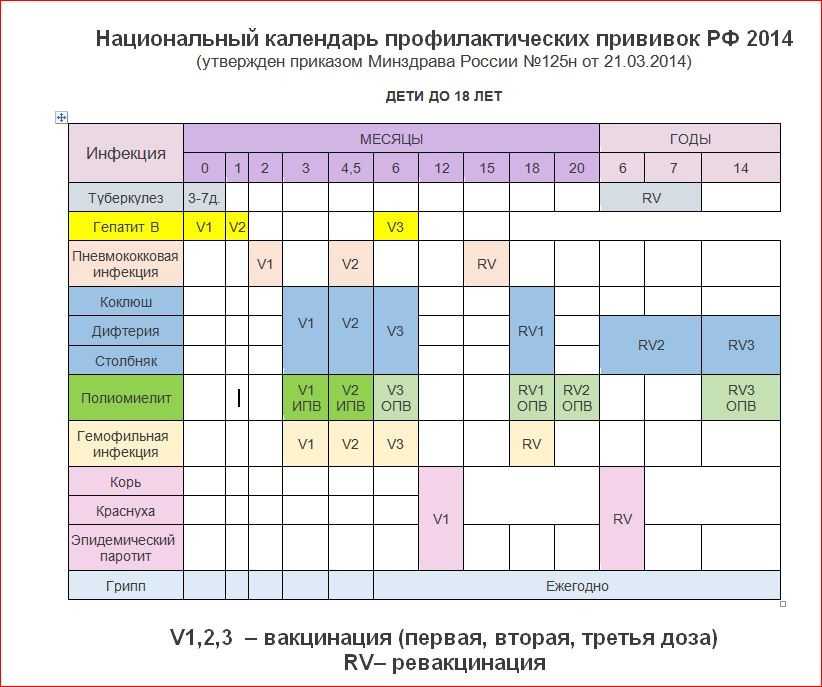 Дж. Вирол.
Дж. Вирол.
75 : 11096-11105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Флинн, Дж. Н., К. А. Кэннон, Д. Слоан, Дж. К. Нил и О. Джарретт.
1999. Подавление репликации вируса иммунодефицита кошек in vitro растворимым фактором, секретируемым CD8 + Т-лимфоцитами. Иммунология
96 : 220-229. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Fouts, T.R., R. Tuskan, K. Godfrey, M. Reitz, D. Hone, G.K. Lewis и A.L. DeVico.
2000. Экспрессия и характеристика одноцепочечного полипептидного аналога рецепторного комплекса gp120-CD4 вируса иммунодефицита человека типа 1. Дж. Вирол.
74 : 11427-11436. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Frey, SCS, EA Hoover и JI Mullins.
2001. Попадание в клетку вируса иммунодефицита кошек. Дж. Вирол.
75 : 5433-5440. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Фрей С., М. Марш, С. Гюнтер, А. Пелхен-Мэттьюз, П. Стивенс, С. Ортлепп и Т. Стегманн.
Фрей С., М. Марш, С. Гюнтер, А. Пелхен-Мэттьюз, П. Стивенс, С. Ортлепп и Т. Стегманн.
1995. Температурная зависимость слияния клеток, индуцированного гликопротеином оболочки вируса иммунодефицита человека типа 1. J. Virol.
69 : 1462-1472. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Gauduin, M.C., PWHI Parren, R. Weir, CF Barbas III, D.R. Burton и RA Koup.
1997. Пассивная иммунизация человеческим моноклональным антителом защищает мышей hu-PBL-SCID от заражения первичными изолятами ВИЧ-1. Нац. Мед.
3 : 1389-1393. [PubMed] [Google Scholar]
23. Джанеккини С., Д. Дель Мауро, Д. Маттеуччи и М. Бендинелли.
2001. Исследования по вакцинации против СПИДа с использованием ex vivo модели вируса иммунодефицита кошек: повторная оценка уровней нейтрализующих антител, вызванных защитной и незащитной вакциной после удаления антисубстратных клеточных антител. Дж. Вирол.
75 : 4424-4429. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Горелик, Р. Дж., Д. Дж. Шабо, Д. Э. Отт, Т. Д. Гальярди, А. Рейн, Л. Э. Хендерсон и Л. О. Артур.
1996. Генетический анализ цинкового пальца в домене нуклеокапсида вируса мышиного лейкоза Молони: замена цинк-координирующих остатков другими цинк-координирующими остатками дает неинфекционные частицы, содержащие геномную РНК. Дж. Вирол.
70 : 2593-2597. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Хейлман, К. А., и Д. Балтимор.
1998. Вакцины против ВИЧ – куда мы идем? Нац. Мед.
4 : 532-534. [PubMed] [Google Scholar]
26. Hioe, C.E., M. Tuen, PC Chien, Jr., G. Jones, S. Ratto-Kim, P.J. Norris, WJ Moretto, D.F. Nixon, M.K. Gorny, and S. Золла-Пазнер.
2001. Ингибирование представления gp120 вируса иммунодефицита человека типа 1 CD4 T-клеткам антителами, специфичными к CD4-связывающему домену gp120. Дж. Вирол.
75 : 10950-10957. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Hohdatsu, T., S. Okada, K. Motokawa, C. Aizawa, JK Yamamoto и H. Koyama.
1997. Действие вакцины двойного подтипа против инфекции, вызванной вирусом иммунодефицита кошек. Вет. микробиол.
58 : 155-165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Hosie, M.J., and O. Jarrett.
1999. Анализ защитного иммунитета, вызванного вакцинацией против вируса иммунодефицита кошек. Доп. Вет. Мед.
41 : 325-332. [PubMed] [Google Scholar]
29. Дженг, Ч. Р., Р. В. Инглиш, Т. Чайлдерс, М. Б. Томпкинс и В. А. Ф. Томпкинс.
1996. Доказательства противовирусной активности CD8 + у кошек, инфицированных вирусом кошачьего иммунодефицита. Дж. Вирол.
70 : 2474-2480. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Канг, С.-Ю., К. Харихаран, П. Нара, Дж. Содроски и Дж. П. Мур.
1994. Иммунизация растворимым комплексом CD4-gp120 предпочтительно индуцирует нейтрализующие антитела против вируса иммунодефицита человека типа 1, направленные на конформационно-зависимые эпитопы gp120. Дж. Вирол.
Иммунизация растворимым комплексом CD4-gp120 предпочтительно индуцирует нейтрализующие антитела против вируса иммунодефицита человека типа 1, направленные на конформационно-зависимые эпитопы gp120. Дж. Вирол.
68 : 5854-5862. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Karlas, JA, KHJ Siebelink, M.A. van Peer, W. Huisman, AM Cuisinier, GF Rimmelzwaan и ADME Osterhaus.
1999. Вакцинация экспериментальными вакцинами против вируса иммунодефицита кошек, основанными на аутологичных инфицированных клетках, вызывает усиление гомологичной контрольной инфекции. Дж. Генерал Вирол.
80 : 761-765. [PubMed] [Google Scholar]
32. LaCasse, R.A., K.E. Follis, M. Trahey, JD Scarborough, D.R. Littman, and JH Nunberg.
1999. Компетентные к слиянию вакцины: широкая нейтрализация первичных изолятов ВИЧ. Наука
283 : 357-362. [PubMed] [Google Scholar]
33. Лаубе, Л. С., М. Бурраскано, К. Э. Дехесус, Б. Д. Ховард, М. А. Джонсон, У. Т. Л. Ли, А. Э. Линн, Г. Питерс, Г. С. Ронлов, К. С. Таунсенд, Р. Л. Исон, Д. Дж. Джолли , Б. Мерчант и Дж. Ф. Уорнер.
Э. Дехесус, Б. Д. Ховард, М. А. Джонсон, У. Т. Л. Ли, А. Э. Линн, Г. Питерс, Г. С. Ронлов, К. С. Таунсенд, Р. Л. Исон, Д. Дж. Джолли , Б. Мерчант и Дж. Ф. Уорнер.
1994. Реакции цитотоксических Т-лимфоцитов и антител, генерируемые у макак-резусов, иммунизированных фибробластами, трансдуцированными ретровирусным вектором, экспрессирующими белки ENV/REV IIIB вируса иммунодефицита человека типа 1. Гум. Джин Тер.
5 : 853-862. [PubMed] [Google Scholar]
34. Lee, S., K. Peden, D.S. Dimitrov, C.C. Broder, J. Manischewitz, G. Denisova, J.M. Gershoni, and H. Golding.
1997. Усиление слияния, опосредованного оболочкой вируса иммунодефицита человека типа 1, моноклональным антителом, специфичным к комплексу CD4-gp120. Дж. Вирол.
71 : 6037-6043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Ломбарди, С., К. Масси, Э. Индино, К. Ла Роса, П. Маццетти, М. Л. Фальконе, П. Роверо, А. Фисси, О. Пьерони, П. Бандекки, Ф.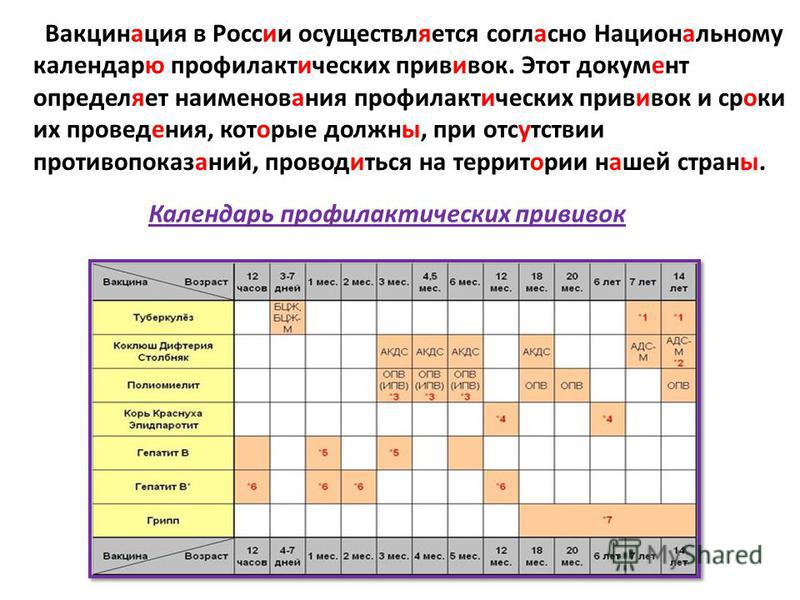 Эспозито, Ф. Тоццини, М. Бендинелли и К. Гарцелли.
Эспозито, Ф. Тоццини, М. Бендинелли и К. Гарцелли.
1996. Ингибирование инфекции вируса иммунодефицита кошек in vitro с помощью синтетических пептидов гликопротеина оболочки. Вирусология
220 : 274-284. [PubMed] [Google Scholar]
36. Люшер, М. А., К. С. Дела Круз, К. С. Макдональд и Б. Х. Барбер.
1998. Относительно подхода к разработке вакцины против ВИЧ типа 1, направленного против основного комплекса гистосовместимости. СПИД рез. Гум. Ретровир.
14 : 541-544. [PubMed] [Google Scholar]
37. Маттеуччи, Д., М. Пистелло, П. Маццетти, С. Джанеккини, Д. Дель Мауро, И. Лонетти, Л. Заккаро, К. Поллера, С. Спектер, и М. Бендинелли.
1997. Исследования вакцинации против СПИДа с использованием ex vivo модели вируса иммунодефицита кошек: защита, обеспечиваемая вакциной с фиксированными клетками, против бесклеточного и ассоциированного с клетками заражения, различается по продолжительности и не может быть легко усилена. Дж. Вирол.
Дж. Вирол.
71 : 8368-8376. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Matteucci, D., M. Pistello, P. Mazzetti, S. Giannecchini, D. Del Mauro, L. Zaccaro, P. Bandecchi, F. Tozzini и М. Бендинелли.
1996. Вакцинация защищает от выращенного in vivo вируса иммунодефицита кошек даже при отсутствии обнаруживаемых нейтрализующих антител. Дж. Вирол.
70 : 617-622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Matteucci, D., M. Pistello, P. Mazzetti, S. Giannecchini, P. Isola, A. Merico, L. Zaccaro, A. Rizzuti, и М. Бендинелли.
1999. Исследования вакцинации против СПИДа с использованием кошачьего вируса иммунодефицита в качестве модели: иммунизация цельным инактивированным вирусом подавляет уровни виремии после интравагинального заражения инфицированными клетками, но не после внутривенного заражения бесклеточным вирусом. вакцина
18 : 119-130. [PubMed] [Google Scholar]
40. Маттеуччи, Д., А. Поли, П. Маццетти, С. Соцци, Ф. Бончи, П. Изола, Л. Заккаро, С. Джанеккини, М. Каландрелла, М. Пистелло, С. Спектер и М. Бендинелли.
Маттеуччи, Д., А. Поли, П. Маццетти, С. Соцци, Ф. Бончи, П. Изола, Л. Заккаро, С. Джанеккини, М. Каландрелла, М. Пистелло, С. Спектер и М. Бендинелли.
2000. Иммуногенность вакцины с фиксированным клеточным вирусом иммунодефицита кошек против клады B у полевых кошек. Дж. Вирол.
74 : 10911-10919. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Mazzetti, P., S. Giannecchini, D. Del Mauro, D. Matteucci, P. Portincasa, A. Merico, C. Chezzi, and M. Бендинелли.
1999. Исследования вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек ex vivo: подробный анализ гуморального иммунного ответа на защитную вакцину. Дж. Вирол.
73 : 1-10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Монтефиори, округ Колумбия, и Дж. П. Мур.
1999. Магия оккультизма? Наука
283 : 336-337. [PubMed] [Google Scholar]
43. Мур, Дж. П. и Д. Р. Бертон.
Бертон.
1999. Нейтрализующие антитела к ВИЧ-1: насколько полна бутылка? Нац. Мед.
5 : 142-144. [PubMed] [Google Scholar]
44. Мур, Дж. П., П. У. Х. И. Паррен и Д. Бертон.
2001. Генетические подтипы, гуморальный иммунитет и разработка вакцин против вируса иммунодефицита человека типа 1. Дж. Вирол.
75 : 5721-5729. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Nabel, G. J.
2001. Проблемы и возможности разработки вакцины против СПИДа. Природа
410 : 1002-1007. [PubMed] [Google Scholar]
46. Натансон Н. и Б. Дж. Мэтисон.
2000. Биологические аспекты разработки вакцины против вируса иммунодефицита человека. Дж. Заразить. Дис.
182 : 579-589. [PubMed] [Google Scholar]
47. Nunberg, JH, K.E. Follis, M. Trahey, and R.A. LaCasse.
2000. Повернуть угол в нейтрализации ВИЧ? микробы заражают.
2 : 213-221. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
48. Overbaugh, J., A.D. Miller, and M.V. Eiden.
2001. Рецепторы и входные кофакторы для ретровирусов включают одиночные и множественные трансмембранные белки, а также недавно описанные гликофосфатидилинозитол-заякоренные и секретируемые белки. микробиол. Мол. биол. преп.
65 : 371-389. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Parren, PWHI, P.A. Marx, A.J. Hessell, A. Luckay, J. Harouse, C. Cheng-Mayer, JP Moore и D.R. Burton.
2001. Антитело защищает макак от вагинального заражения патогенным вирусом иммунодефицита обезьян R5/человека при уровнях в сыворотке, обеспечивающих полную нейтрализацию in vitro. Дж. Вирол.
75 : 8340-8347. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Parren, PWHI, JP Moore, DR Burton и QJ Sattentau.
1999. Реакция нейтрализующих антител на ВИЧ-1: ускользание вируса и уход от гуморального иммунитета.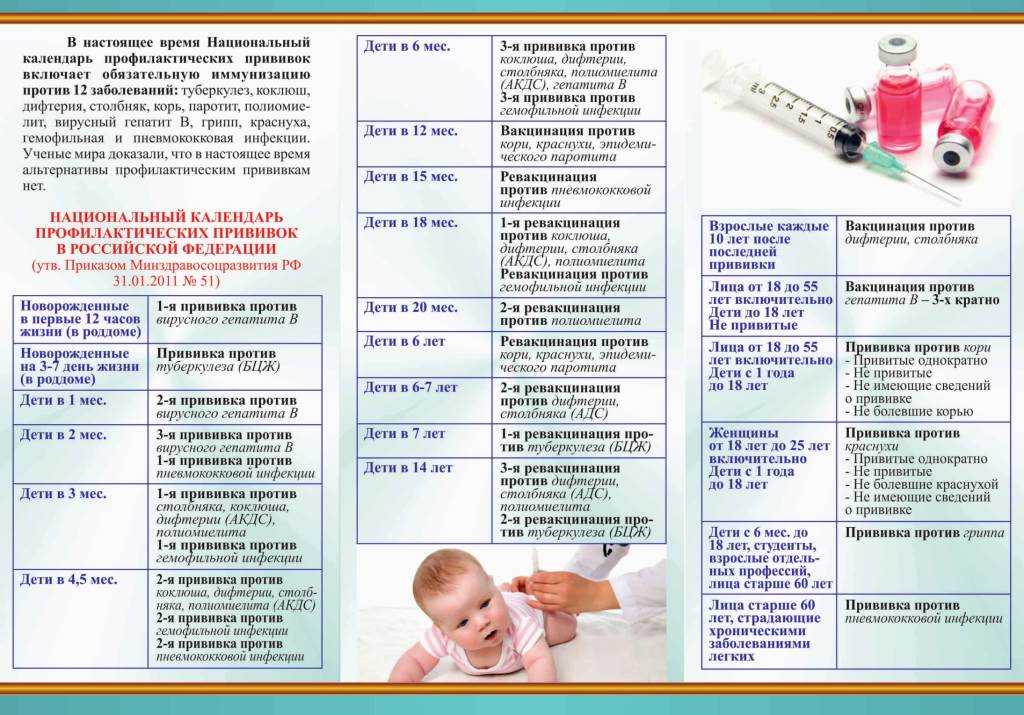 СПИД
СПИД
13 : S137-S162. [PubMed] [Google Scholar]
51. Педерсен, Северная Каролина, Э. У. Хо, М. Л. Браун и Дж. К. Ямамото.
1987. Выделение Т-лимфотропного вируса от домашних кошек с синдромом иммунодефицита. Наука
235 : 790-793. [PubMed] [Google Scholar]
52. Пистелло М., А. Моррика, Ф. Магги, М. Л. Ваттерони, Г. Фрир, К. Форнаи, Ф. Казула, С. Марчи, П. Чиккоросси, П. Роверо и М. Бендинелли.
2001. Уровень вируса ТТ в плазме крови инфицированных лиц с различной печеночной и внепеченочной патологией. Дж. Мед. Вирол.
63 : 189-195. [PubMed] [Google Scholar]
53. Pu, R., J. Coleman, M. Omori, M. Arai, T. Hohdatsu, C. Huang, T. Tanabe и JK Yamamoto.
2001. Вакцина против FIV двойного подтипа защищает кошек от роев in vivo как гомологичных, так и гетерологичных изолятов FIV подтипа. СПИД
15 : 1225-1237. [PubMed] [Академия Google]
54. Рид Л. Дж. и Х. А. Мюнх.
Рид Л. Дж. и Х. А. Мюнх.
1938. Простой метод оценки пятидесятипроцентных конечных точек. Являюсь. Дж. Хиг.
27 : 493-497. [Google Scholar]
55. Ричардсон Дж., Г. Панчино, Р. Мерат, Т. Лесте-Лассер, А. Морайон, Дж. Шнайдер-Мергенер, М. Ализон, П. Сониго и Н. Хевекер .
1999. Совместное использование хемокинового рецептора CXCR4 первичными и лабораторно-адаптированными штаммами вируса иммунодефицита кошек. Дж. Вирол.
73 : 3661-3671. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Россио, Дж. Л., М. Т. Эссер, К. Сурьянараяна, Д. К. Шнайдер, Дж. В. Бесс, младший, Г. М. Васкес, Т. А. Уилтраут, Э. Чертова, М. К. Граймс, К. Саттентау, Л. О. Артур, Л. Э. Хендерсон и Дж. Д. Лифсон.
1998. Инактивация инфекционности вируса иммунодефицита человека типа 1 с сохранением конформационной и функциональной целостности белков поверхности вириона. Дж. Вирол.
72 : 7992-8001.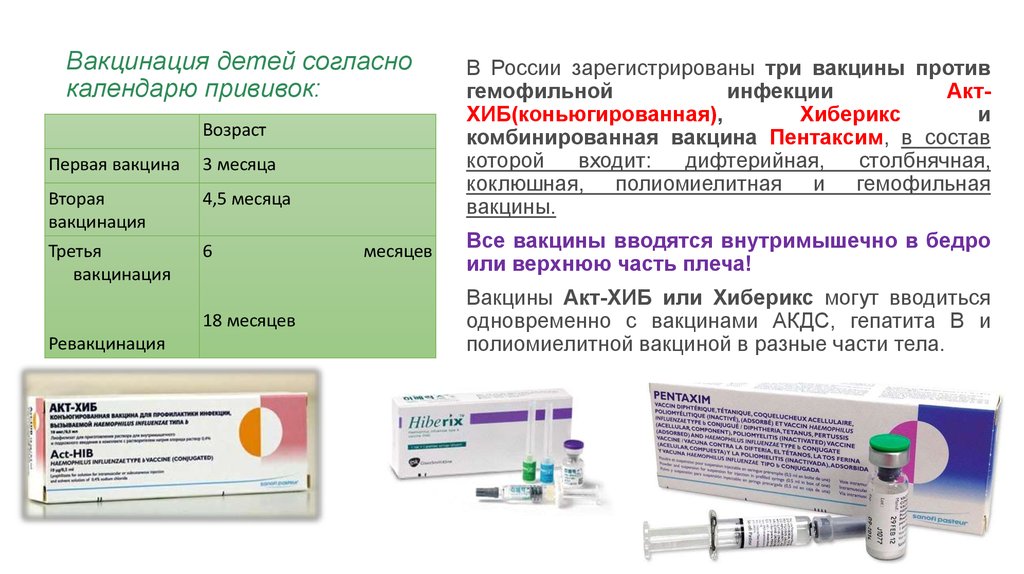 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Spenlehauer, C., A. Kirn, A.-M. Обертен и К. Муг.
2001. Опосредованная антителами нейтрализация первичных изолятов вируса иммунодефицита человека типа 1: исследование механизма ингибирования. Дж. Вирол.
75 : 2235-2245. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Stott, EJ, and GC Schild.
1996. Стратегии вакцин против СПИДа. Дж. Антимикроб. Чемотер.
37 : 185-198. [PubMed] [Google Scholar]
59. Talbott, R.L., EE Sparger, K.M. Lovelace, WM Fitch, NC Pedersen, PA Luciw, and JH Elder.
1989. Нуклеотидная последовательность и геномная организация вируса иммунодефицита кошек. проц. Натл. акад. науч. США
86 : 5743-5747. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Thali, M., JP Moore, C. Furman, M. Charles, DD Ho, J. Robinson, and J. Sodroski.
1993. Характеристика консервативных эпитопов нейтрализации gp120 вируса иммунодефицита человека типа 1, экспонируемых при связывании gp120-CD4. Дж. Вирол.
Дж. Вирол.
67 : 3978-3988. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Tremblay, M.J., J.-F. Фортин и Р. Кантин.
1998. Приобретение зарождающимся ВИЧ-1 белков, кодируемых хозяином. Иммунол. Сегодня
19 : 346-351. [PubMed] [Google Scholar]
62. Туммино, П. Дж., Дж. Д. Шолтен, П. Дж. Харви, Т. П. Холлер, Л. Мэлони, Р. Гоглиотти, Дж. Домагала и Д. Хьюп.
1996. Выделение цинка in vitro из нуклеокапсидного белка вируса иммунодефицита человека (ВИЧ) типа 1 с помощью дисульфидных бензамидов с клеточной активностью против ВИЧ. проц. Натл. акад. науч. США
93 : 969-973. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Wang, Y.F., L. Tao, E. Mitchell, C. Bravery, P. Berlingieri, P. Armstrong, R. Vaughan, J. Underwood и Т. Ленер.
1999. Аллоиммунизация выявляет хемокины, происходящие из CD8+ Т-клеток, супрессорные факторы ВИЧ и устойчивость к ВИЧ-инфекции у женщин. Нац. Мед.
Нац. Мед.
5 : 1004-1009. [PubMed] [Google Scholar]
64. Willett, BJ, JN Flynn, and MJ Hosie.
1997. Заражение FIV домашней кошки: животная модель СПИДа. Иммунол. Сегодня
18 : 182-189. [PubMed] [Google Scholar]
65. Willett, BJ, L. Picard, MJ Hosie, JD Turner, K. Adema и P.R. Clapham.
1997. Совместное использование хемокинового рецептора CXCR4 вирусами иммунодефицита кошек и человека. Дж. Вирол.
71 : 6407-6415. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Wyatt, R., and J. Sodroski.
1998. Гликопротеины оболочки ВИЧ-1: фузогены, антигены и иммуногены. Наука
280 : 1884-1888. [PubMed] [Google Scholar]
67. Ямамото, Дж. К., Т. Ходацу, Р. А. Олмстед, Р. Пу, Х. Луи, Х. А. Зохлински, В. Асеведо, Х. М. Джонсон, Г. А. Соулдс и М. Б. Гарднер.
1993. Экспериментальная вакцина для защиты от гомологичных и гетерологичных штаммов вируса иммунодефицита кошек. Дж. Вирол.
Дж. Вирол.
67 : 601-605. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Yamamoto, JK, T. Okuda, CD Ackley, H. Louie, E. Pembroke, H. Zochlinski, RJ Munn и MB Gardner.
1991. Экспериментальная вакцина для защиты от вируса иммунодефицита кошек. СПИД рез. Гум. Ретровир.
7 : 911-922. [PubMed] [Google Scholar]
69. Yang, X., R. Wyatt, and J. Sodroski.
2001. Улучшение выявления нейтрализующих антител против первичных вирусов иммунодефицита человека с помощью тримеров растворимых стабилизированных оболочечных гликопротеинов. Дж. Вирол.
75 : 1165-1171. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. York, J., K.E. Follis, M. Trahey, PN Nyambi, S. Zolla-Pazner и JH Nunberg.
2001. Связывание антител и нейтрализация первичных и адаптированных к линии Т-клеток изолятов вируса иммунодефицита человека типа 1. J. Virol.
75 : 2741-2752. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
Современная мРНК-вакцина против ВИЧ: первые пациенты вакцинированы в клинических испытаниях
Moderna запустила первую фазу клинических испытаний экспериментальной вакцины против ВИЧ, в которой используется технология мРНК.
Джозеф Прециозо/AFP/Getty Images
Си-Эн-Эн
—
Компания объявила на прошлой неделе, что первые участники были вакцинированы в рамках фазы 1 клинических испытаний экспериментальной вакцины против ВИЧ, в которой используется технология мРНК Moderna.
Испытание под названием IAVI G002 проводится в партнерстве с IAVI, некоммерческой научно-исследовательской организацией. Это тестирование вакцины, которая доставляет в организм специфические антигены ВИЧ с целью вызвать иммунный ответ. Эти антигены были первоначально разработаны исследователями IAVI и Scripps Research под руководством доктора Уильяма Шифа.
Это тестирование вакцины, которая доставляет в организм специфические антигены ВИЧ с целью вызвать иммунный ответ. Эти антигены были первоначально разработаны исследователями IAVI и Scripps Research под руководством доктора Уильяма Шифа.
Вывеска перед штаб-квартирой Gilead Sciences 29 апреля 2020 года в Фостер-Сити, Калифорния.
Джастин Салливан / Getty Images
Компания Gilead объявила о массовом изъятии поддельных лекарств от ВИЧ-1
В прошлом году в ходе «доказательства концепции» исследовательская группа обнаружила, что антигены ВИЧ вызывают желаемый иммунный ответ у 97% участников. Текущее испытание основано на предыдущем, тестируя основную версию вакцины, а также бустерную версию, а также используя технологию мРНК Moderna, которая ранее использовалась для создания успешного Covid-19. вакцина.
вакцина.
«Мы очень рады продвигать это новое направление в разработке вакцин против ВИЧ с помощью платформы мРНК Moderna. Поиск вакцины против ВИЧ был долгим и сложным, и наличие новых инструментов с точки зрения иммуногенов и платформ может стать ключом к быстрому прогрессу в создании срочно необходимой эффективной вакцины против ВИЧ», — сказал Марк Фейнберг, президент и главный исполнительный директор IAVI. пресс-релиз от Moderna.
В новом испытании, частично финансируемом Фондом Билла и Мелинды Гейтс, примут участие 56 ВИЧ-отрицательных взрослых с целью изучения как безопасности, так и эффективности вакцины. Сорок восемь добровольцев получат по крайней мере одну дозу первичной вакцины, 32 из которых также получат ревакцинацию.

