Содержание
Чем борьба с прививками грозит нам всем. Фрагмент книги Пола Оффита — о том, как в США судились с изготовителями вакцин.
В конце сентября в издательстве Corpus при поддержке фонда «Эволюция» выходит книга американского педиатра и популяризатора прививок Пола Оффита «Смертельно опасный выбор. Чем борьба с прививками грозит нам всем», в которой автор детально разбирает наиболее популярные антипрививочные кампании и последовательно доказывает необходимость вакцинации детей. С разрешения издательства «Медуза» публикует фрагмент из главы «Правосудие», описывающей, как в США в двухтысячных действовала Программа компенсаций пострадавшим от прививок. Перевод с английского Анастасии Бродоцкой.
Двадцать лет своего существования Программа компенсаций пострадавшим от прививок раздавала деньги весьма щедро. У истцов было несколько путей к победе. Иногда программа просто признавала, что претензия обоснованна. Например, компенсация незамедлительно выплачивалась любому ребенку, парализованному после прививки оральной вакциной Альберта Сэйбина против полиомиелита. Если же подозрение, что прививка стала причиной того или иного заболевания, в том числе аутизма, не считалось обоснованным, правительство назначало судей, так называемых судебных распорядителей, которые слушали разбирательство в суде по делам о вакцинах. Если судебные распорядители отклоняли иск, оставалось три варианта. Проситель мог обратиться в Претензионный суд США, если такой возможности не было — в Федеральный окружной апелляционный суд или же подать иск на изготовителей вакцины в суд штата. С годами сумма, имевшаяся в распоряжении Программы компенсаций пострадавшим от прививок, становилась все больше и больше за счет государственного акцизного сбора с каждой дозы вакцины, и к 2009 году у Программы накопилось уже 2 миллиарда долларов, а средняя выплата составляла 900 000 долларов.
Если же подозрение, что прививка стала причиной того или иного заболевания, в том числе аутизма, не считалось обоснованным, правительство назначало судей, так называемых судебных распорядителей, которые слушали разбирательство в суде по делам о вакцинах. Если судебные распорядители отклоняли иск, оставалось три варианта. Проситель мог обратиться в Претензионный суд США, если такой возможности не было — в Федеральный окружной апелляционный суд или же подать иск на изготовителей вакцины в суд штата. С годами сумма, имевшаяся в распоряжении Программы компенсаций пострадавшим от прививок, становилась все больше и больше за счет государственного акцизного сбора с каждой дозы вакцины, и к 2009 году у Программы накопилось уже 2 миллиарда долларов, а средняя выплата составляла 900 000 долларов.
Суд по делам о вакцинах был местом необычным. В 1988 году, когда он только начал присуждать истцам крупные суммы, шкала компенсаций была достаточно свободной и программа компенсировала осложнения, вызванные не вакцинами. Например, в 1992 году суд постановил, что АКДС стало причиной эпилепсии, хотя у ребенка, чье дело рассматривалось, был синдром Ретта — наследственное заболевание, как известно, вызывающее судороги. Кроме того, суд, как правило, выплачивал компенсации родителям, чьи дети погибли от синдрома внезапной детской смерти, хотя к тому времени исследования уже показали, что связь между вакцинами и СВДС отсутствует. Случалось ему присуждать и еще более удивительные компенсации. Истцам удавалось убедить суд, что плач, нервозность и сонливость у ребенка после прививки АКДС — это признак поражения мозга, приводящего к синдрому дефицита внимания. Впоследствии один адвокат признался, что по меньшей мере треть всех исков против АКДС на самом деле были необоснованны. Вероятно, лучшим примером царившей в суде вакханалии стал иск одной дамы, которая утверждала, что ее пес «поглупел» после прививки от бешенства.
Например, в 1992 году суд постановил, что АКДС стало причиной эпилепсии, хотя у ребенка, чье дело рассматривалось, был синдром Ретта — наследственное заболевание, как известно, вызывающее судороги. Кроме того, суд, как правило, выплачивал компенсации родителям, чьи дети погибли от синдрома внезапной детской смерти, хотя к тому времени исследования уже показали, что связь между вакцинами и СВДС отсутствует. Случалось ему присуждать и еще более удивительные компенсации. Истцам удавалось убедить суд, что плач, нервозность и сонливость у ребенка после прививки АКДС — это признак поражения мозга, приводящего к синдрому дефицита внимания. Впоследствии один адвокат признался, что по меньшей мере треть всех исков против АКДС на самом деле были необоснованны. Вероятно, лучшим примером царившей в суде вакханалии стал иск одной дамы, которая утверждала, что ее пес «поглупел» после прививки от бешенства.
Но в 1995 году все переменилось. К вящей радости врачебного сообщества шкалу компенсаций программы сделали значительно строже. Родители больше не могли рассчитывать на успех, заявляя, что вакцина АКДС вызывает необратимое поражение мозга, СВДС или генетические нарушения. Барбара Ло Фишер, стоявшая у истоков программы, пришла в ярость. «Государственная система компенсации, которая, как нам говорили, должна была стать „простым правосудием для детей“, обернулась жестоким розыгрышем». Впрочем, Барбаре Ло Фишер не о чем было тревожиться: череда необъяснимых постановлений только началась.
Родители больше не могли рассчитывать на успех, заявляя, что вакцина АКДС вызывает необратимое поражение мозга, СВДС или генетические нарушения. Барбара Ло Фишер, стоявшая у истоков программы, пришла в ярость. «Государственная система компенсации, которая, как нам говорили, должна была стать „простым правосудием для детей“, обернулась жестоким розыгрышем». Впрочем, Барбаре Ло Фишер не о чем было тревожиться: череда необъяснимых постановлений только началась.
Первой ласточкой был удивительный случай Маргарет Алтен. Двадцать восьмого марта 1997 года сорокадевятилетней Маргарет Алтен сделали прививку от столбняка и гепатита А. Через две недели у нее начались головные боли и появилась нечеткость зрения. После всестороннего обследования лечащие врачи Алтен диагностировали у нее заболевание, похожее на рассеянный склероз. К тому времени, когда дело Алтен рассматривалось Программой компенсаций, накопилось достаточно научных данных, доказывавших, что прививки не вызывают подобных недугов. Поэтому судебный распорядитель отклонил требование Алтен о компенсации. Однако судьи из Федерального апелляционного суда с ним не согласились. Они решили, что юристам истицы нужно сделать всего три вещи: предложить теорию, как вакцина могла вызвать заболевание, предложить логическую цепочку причинно-следственных связей и, наконец, показать, что эти два события связаны по времени. Юристы истицы не обязаны были подкреплять свой иск никакими эпидемиологическими или биологическими данными. От них требовалось лишь показать, что болезнь была диагностирована после прививки, и предложить теорию, как такое могло произойти — весьма несложная задача.
Поэтому судебный распорядитель отклонил требование Алтен о компенсации. Однако судьи из Федерального апелляционного суда с ним не согласились. Они решили, что юристам истицы нужно сделать всего три вещи: предложить теорию, как вакцина могла вызвать заболевание, предложить логическую цепочку причинно-следственных связей и, наконец, показать, что эти два события связаны по времени. Юристы истицы не обязаны были подкреплять свой иск никакими эпидемиологическими или биологическими данными. От них требовалось лишь показать, что болезнь была диагностирована после прививки, и предложить теорию, как такое могло произойти — весьма несложная задача.
Затем последовало решение по иску Капиззано. Третьего мая 1998 года Роуз Капиззано получила вторую дозу вакцины против гепатита В, после чего у нее появилась сыпь, а также болезненность и ограничение подвижности суставов. В дальнейшем врачи поставили ей диагноз «ревматоидный артрит». И снова научные данные опровергали представление, будто вакцина против гепатита В вызывает ревматоидный артрит. Поэтому судебный распорядитель отклонил иск. Однако, как и в деле Маргарет Алтен, Федеральный апелляционный суд отменил это решение. Судьи апелляционного суда отметили, что, по мнению лечащего врача Роуз Капиззано, ее артрит был вызван именно прививкой, и для них этого оказалось достаточно. Они постановили: «В случаях, когда речь идет о вакцинах, суд отдает предпочтение медицинским документам и мнению специалистов-медиков, поскольку именно лечащие врачи в состоянии лучше всего определить, существует ли причинно-следственная связь между вакцинацией и болезнью». Это постановление означало, что мнение лечащего врача может перевесить принятый во врачебном сообществе консенсус, всю совокупность эпидемиологических и биологических данных, десятилетия коллективного клинического опыта. Точка зрения одного-единственного врача могла свести все это на нет.
Поэтому судебный распорядитель отклонил иск. Однако, как и в деле Маргарет Алтен, Федеральный апелляционный суд отменил это решение. Судьи апелляционного суда отметили, что, по мнению лечащего врача Роуз Капиззано, ее артрит был вызван именно прививкой, и для них этого оказалось достаточно. Они постановили: «В случаях, когда речь идет о вакцинах, суд отдает предпочтение медицинским документам и мнению специалистов-медиков, поскольку именно лечащие врачи в состоянии лучше всего определить, существует ли причинно-следственная связь между вакцинацией и болезнью». Это постановление означало, что мнение лечащего врача может перевесить принятый во врачебном сообществе консенсус, всю совокупность эпидемиологических и биологических данных, десятилетия коллективного клинического опыта. Точка зрения одного-единственного врача могла свести все это на нет.
Постановления по искам Алтен и Капиззано открыли дорогу целой череде постыдных решений. С 2001 по 2008 год суд постановил, что вакцины против гепатита В и Hib-инфекции вызывали паралич, вакцина против кори, краснухи и паротита вызывала эпилепсию и фибромиалгию (синдром неизвестного происхождения, для которого характерны мышечные боли и слабость), вакцина против гепатита В вызывала синдром Гийена — Барре, а вакцина против краснухи — хронический артрит, и все это несмотря на обилие доказательств, что подобных побочных эффектов у этих вакцин нет. Однако самое нелогичное, самое необоснованное, внушающее самую серьезную тревогу (тем, кого заботила жизнеспособность программы) из всех этих решений — это вердикт по иску Дороти Вердерич.
Однако самое нелогичное, самое необоснованное, внушающее самую серьезную тревогу (тем, кого заботила жизнеспособность программы) из всех этих решений — это вердикт по иску Дороти Вердерич.
Одиннадцатого ноября 1992 года тридцатитрехлетней медсестре Дороти Вердерич ввели первую дозу вакцины против гепатита В, а месяц спустя — вторую. Вскоре после этого она пожаловалась на онемение левой половины тела, а затем ослепла на один глаз. Второго февраля 1993 года после многочисленных анализов и исследований врачи установили диагноз: рассеянный склероз. Двадцать шестого мая 2006 года судебный распорядитель постановил, что рассеянный склероз у Дороти Вердерич вызван вакциной против гепатита В.
Идея, будто вакцина против гепатита В вызывает рассеянный склероз, не получила научного подтверждения. Во-первых, вирусный белок в вакцине (поверхностный белок вируса гепатита В) и вирусный белок, обнаруживаемый в крови при естественном заражении, идентичны. Поэтому, если вакцина и вызывает какую-то болезнь, ту же болезнь должно вызывать и естественное заражение. Однако рассеянный склероз у людей, зараженных гепатитом В, встречается не чаще, чем в целом в популяции, а реже. Кроме того, два крупных эпидемиологических исследования, проведенные учеными из Гарвардской школы здравоохранения и Университета Макгилла в Монреале, охватившие десятки тысяч испытуемых и опубликованные в New England Journal of Medicine, не выявили никакой связи между этими заболеваниями. Когда судебный распорядитель постановил, что рассеянный склероз у Дороти Вердерич вызван вакциной против гепатита В, результаты обоих исследований были уже обнародованы.
Однако рассеянный склероз у людей, зараженных гепатитом В, встречается не чаще, чем в целом в популяции, а реже. Кроме того, два крупных эпидемиологических исследования, проведенные учеными из Гарвардской школы здравоохранения и Университета Макгилла в Монреале, охватившие десятки тысяч испытуемых и опубликованные в New England Journal of Medicine, не выявили никакой связи между этими заболеваниями. Когда судебный распорядитель постановил, что рассеянный склероз у Дороти Вердерич вызван вакциной против гепатита В, результаты обоих исследований были уже обнародованы.
Пожалуй, никто не сумеет лучше рассказать о происходящем за кулисами Программы компенсаций пострадавшим от прививок, чем Люси Рорк-Адамс, профессор патологии в Детской больнице Филадельфии. Каждый раз, когда смерть ребенка связывают с прививкой, Рорк-Адамс изучает мозг умершего. Ее необычная роль в Программе компенсаций пострадавшим от прививок объясняется удивительными особенностями ее биографии.
Люси Рорк-Адамс — пятая и последняя дочь эмигрантов из Армении, чудом уцелевших во время турецких погромов. Хотя родилась и выросла Люси в городе Сент-Пол в штате Миннесота, ее родители говорили только по-армянски. «Когда я пошла в детский сад, английского я не знала, и весь день просидела на качелях в дверном проеме между классной и гардеробом и проплакала», — вспоминала она. В период с 1947 по 1957 год Люси Рорк-Адамс получила степени бакалавра искусств, магистра искусств по психологии, бакалавра наук по медицине и доктора медицины — все в Университете штата Миннесота. После медицинской школы Люси прошла интернатуру в Филадельфии. Там она познакомилась с ученым, который круто изменил ее карьеру. «Главой отделения патологии в Многопрофильной больнице Филадельфии был Уильям Эрих, — вспоминает она. — Доктор Эрих учился у Людвига Ашоффа, а тот — у Фридриха Даниеля фон Реклингхаузена, который, в свою очередь, был учеником отца патологии Рудольфа Вирхова. Я считаю себя праправнучкой Вирхова — с научной точки зрения!». (Имена всех этих легендарных немецких патологов увековечены в различных медицинских терминах.
Хотя родилась и выросла Люси в городе Сент-Пол в штате Миннесота, ее родители говорили только по-армянски. «Когда я пошла в детский сад, английского я не знала, и весь день просидела на качелях в дверном проеме между классной и гардеробом и проплакала», — вспоминала она. В период с 1947 по 1957 год Люси Рорк-Адамс получила степени бакалавра искусств, магистра искусств по психологии, бакалавра наук по медицине и доктора медицины — все в Университете штата Миннесота. После медицинской школы Люси прошла интернатуру в Филадельфии. Там она познакомилась с ученым, который круто изменил ее карьеру. «Главой отделения патологии в Многопрофильной больнице Филадельфии был Уильям Эрих, — вспоминает она. — Доктор Эрих учился у Людвига Ашоффа, а тот — у Фридриха Даниеля фон Реклингхаузена, который, в свою очередь, был учеником отца патологии Рудольфа Вирхова. Я считаю себя праправнучкой Вирхова — с научной точки зрения!». (Имена всех этих легендарных немецких патологов увековечены в различных медицинских терминах.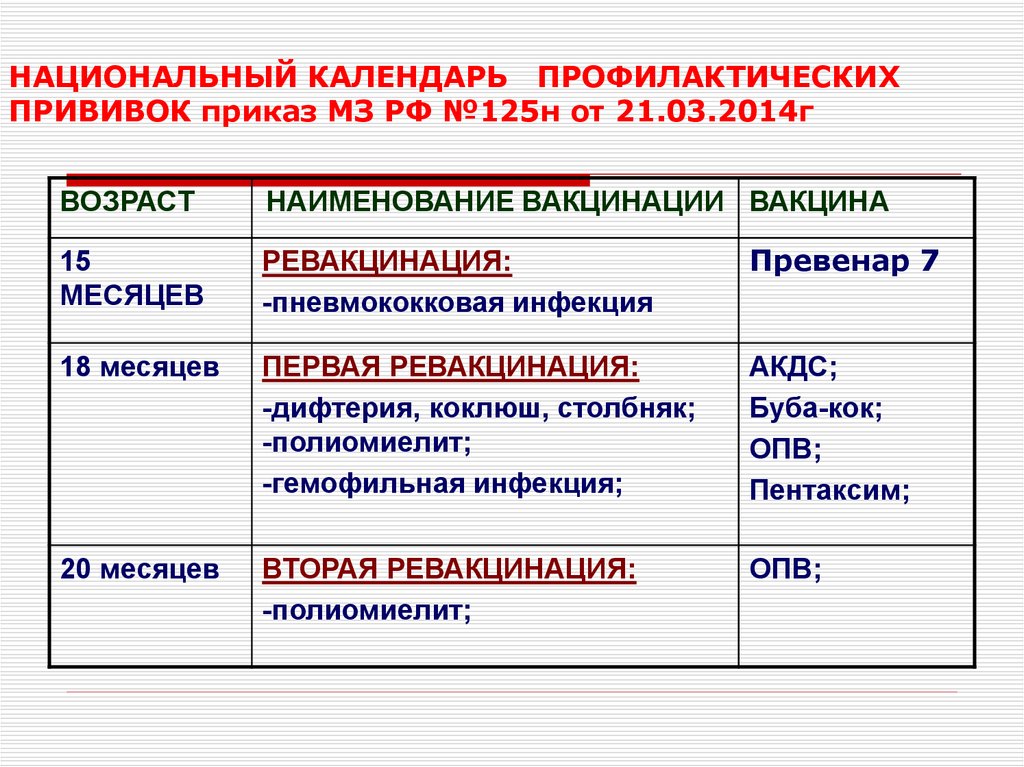 )
)
Проработав в своей области более сорока лет, Люси Рорк-Адамс стала всемирно известным педиатром-невропатологом, и к ней за консультациями обращаются коллеги со всего мира. Она была в числе ученых, которым после смерти Альберта Эйнштейна прислали образец его мозга для исследований. То, что адвокаты защиты в суде по делам о вакцинах так часто обращаются за экспертизой к Люси Рорк-Адамс, — свидетельство их серьезности и добросовестности.
К настоящему времени Люси Рорк-Адамс исследовала мозг 33 детей, погибших после прививки либо страдающих необъяснимыми судорожными припадками, потребовавшими биопсии мозга. Ей до сих пор не удалось выявить ни одного случая, когда причиной несчастья действительно стала вакцина. «Зато я нашла самые разные аномалии и болезни, которыми можно объяснить то, что произошло с этими детьми», — говорит доктор Рорк-Адамс. Она обнаружила, что одни дети погибли от пороков развития, дегенеративных болезней, сосудистых расстройств и инфекций, другие — от случайного удушья или в результате насилия. «Итог таков: нет никаких данных с точки зрения научной, а теперь и патологической экспертизы, что причиной случившегося была вакцина», — говорит она.
«Итог таков: нет никаких данных с точки зрения научной, а теперь и патологической экспертизы, что причиной случившегося была вакцина», — говорит она.
Бесклеточные вакцины для профилактики коклюша (pertussis) у детей
Вопрос обзора
Нашей целью было ответить на вопрос, являются ли бесклеточные вакцины такими же эффективными как цельноклеточные вакцины в защите детей от коклюша, но с меньшим числом побочных эффектов.
Актуальность
Коклюш может быть серьезной респираторной инфекцией у детей и вызывается бактерией Bordetella pertussis (B.pertussis). Вакцины, изготовленные из убитых цельных B.pertussis, известные как цельноклеточные коклюшные вакцины, могут вызывать тяжелые неврологические расстройства и незначительные (минорные) побочные эффекты, такие как анорексия (отсутствие аппетита), сонливость, лихорадка, раздражительность, продолжительный плач, рвота и боль/покрасснение/припухлость/уплотнение в месте инъекции. Это приводило к сокращению показателей иммунизации, и, в результате, к увеличению числа случаев коклюша. Бесклеточные коклюшные вакцины (содержащие более очищенные антигены B.pertussis) были разработаны в надежде на то, что они будут такими же эффективными, как цельноклеточные коклюшные вакцины, но более безопасными.
Это приводило к сокращению показателей иммунизации, и, в результате, к увеличению числа случаев коклюша. Бесклеточные коклюшные вакцины (содержащие более очищенные антигены B.pertussis) были разработаны в надежде на то, что они будут такими же эффективными, как цельноклеточные коклюшные вакцины, но более безопасными.
Даты поиска
Мы провели поиск клинических испытаний, опубликованных до января 2014 года.
Характеристики исследований
Мы включили клинические испытания, сравнивающие эффективность и безопасность цельноклеточных и бесклеточных коклюшных вакцин у детей до 6 лет.
Основные результаты
Этот обновленный обзор включил 6 клинических испытаний с 46283 участниками, оценивающих эффективность, и 52 клинических испытания с 136541 участником, оценивающих безопасность коклюшных вакцин. Длительность варьировали от 12 до 27 месяцев и от 3 дней до 12 месяцев для клинических испытаний эффективности и клинических испытаний безопасности соответственно. Эффективность бесклеточных вакцин с тремя и более компонентами варьировала от 84% до 85% в профилактике типичного коклюша (характеризующегося тяжелыми приступами кашля в течение 21 или более дней подряд и лабораторно-подтвержденной инфекцией B.pertussis или контактом с членом семьи, который имеет культурально-подтвержденный коклюш) и от 71% до 78% в профилактике легкой формы коклюша (характеризующейся числом последовательных дней кашля — 7 или более, с лабораторно доказанной B.pertussis инфекцией). В противоположность этому, эффективность вакцин с одним и двумя компонентами варьировала от 59% до 78% в защите против типичного коклюша и от 41% до 58% против легкой формы коклюша. Большинство системных и локальных побочных эффектов на первые дозы и бустер-дозы (ревакцинация) были значительно меньше распространены при использовании бесклеточных вакцин, чем при использовании цельноклеточных вакцин. Мы обнаружили, что бесклеточные коклюшные вакцины с тремя и более компонентами более эффективны, чем низко-эффективные цельноклеточные вакцины, но могут быть менее эффективны, чем высоко-эффективные цельноклеточные вакцины.
Эффективность бесклеточных вакцин с тремя и более компонентами варьировала от 84% до 85% в профилактике типичного коклюша (характеризующегося тяжелыми приступами кашля в течение 21 или более дней подряд и лабораторно-подтвержденной инфекцией B.pertussis или контактом с членом семьи, который имеет культурально-подтвержденный коклюш) и от 71% до 78% в профилактике легкой формы коклюша (характеризующейся числом последовательных дней кашля — 7 или более, с лабораторно доказанной B.pertussis инфекцией). В противоположность этому, эффективность вакцин с одним и двумя компонентами варьировала от 59% до 78% в защите против типичного коклюша и от 41% до 58% против легкой формы коклюша. Большинство системных и локальных побочных эффектов на первые дозы и бустер-дозы (ревакцинация) были значительно меньше распространены при использовании бесклеточных вакцин, чем при использовании цельноклеточных вакцин. Мы обнаружили, что бесклеточные коклюшные вакцины с тремя и более компонентами более эффективны, чем низко-эффективные цельноклеточные вакцины, но могут быть менее эффективны, чем высоко-эффективные цельноклеточные вакцины. Бесклеточные вакцины имеют меньше побочных эффектов, чем цельноклеточные вакцины.
Бесклеточные вакцины имеют меньше побочных эффектов, чем цельноклеточные вакцины.
Значение для практики
Значение результатов этого обзора для клинической практики может отличаться для стран с низким и высоким уровнем дохода. В странах с высоким уровнем дохода смертность от коклюша встречается редко и согласие родителей является основным фактором при использовании иммунизации. При таких обстоятельствах улучшенный профиль побочных эффектов бесклеточных вакцин говорит в пользу их использования, даже если при этом приходится жертвовать некоторой степенью эффективности по сравнению с самыми лучшими цельноклеточными вакцинами. В странах с низким уровнем дохода, где риск коклюша выше и больше вероятность смертельных случаев, больший вес необходимо отдавать эффективности вакцины. Если бесклеточная вакцина показала меньшую эффективность, чем высоко-эффективная цельноклеточная вакцина, ее необходимо заменить, преимущества безопасности бесклеточной вакцины могут быть компенсированы увеличенной смертностью и заболеваемостью за счет существенно большего роста коклюша. Однако, большинство цельноклеточных вакцин, используемых в странах с низким уровнем дохода, не были надлежащим образом изучены на предмет эффективности и, следовательно, не известно, где, в широком спектре эффективности цельноклеточной вакцины располагается индивидуальный продукт.
Однако, большинство цельноклеточных вакцин, используемых в странах с низким уровнем дохода, не были надлежащим образом изучены на предмет эффективности и, следовательно, не известно, где, в широком спектре эффективности цельноклеточной вакцины располагается индивидуальный продукт.
Качество доказательств
Все включенные клинические испытания были рандомизированными и двойными-слепыми, то есть участники имели равные шансы на получение либо бесклеточной, либо цельноклеточной вакцины, и исследователям, и участникам не было известно о назначенном лечении. Однако в большинстве клинических испытаний не сообщали о деталях этих методологических приемов. Это может поставить под некоторую неопределенность качество доказательств этого обзора.
Выводы авторов:
Мульти-компонентные (≥трех) бесклеточные коклюшные вакцины эффективны в профилаткике коклюша у детей. Мульти-компонентные бесклеточные коклюшные вакцины имеют более высокую эффективность, чем низко-эффективные цельноклеточные коклюшные вакцины, но могут быть менее эффективными, чем высоко-эффективные цельноклеточные коклюшные вакцины. Бесклеточные вакцины имеют меньше побочных эффектов, чем цельноклеточные вакцины, как при первичном использовании (вакцинации), так и при использовании бустер-доз (ревакцинации).
Бесклеточные вакцины имеют меньше побочных эффектов, чем цельноклеточные вакцины, как при первичном использовании (вакцинации), так и при использовании бустер-доз (ревакцинации).
Читайте полный текст реферата…
Введение и актуальность:
Рутинное использование цельноклеточных коклюшных вакцин было приостановлено в некоторых странах в 1970-х и 1980-х годах в связи с обеспокоенностью в отношении побочных эффектов. После этих действий был подъем заболеваемости коклюшем. Бесклеточные коклюшные вакцины, содержащие очищенные или рекомбинантные антигены Bordetella pertussis (B.pertussis) были разработаны в надежде на то, что они будут такими же эффективными, но менее реактогенными, чем цельноклеточные вакцины. Это обновление Кокрейновского обзора, впервые опубликованного в 1999 году и ранее обновленного в 2012 году. В это обновление мы не включили никаких новых исследований.
Задачи:
Оценить эффективность и безопасность бесклеточных вакцин у детей и сравнить их с цельноклеточными вакцинами.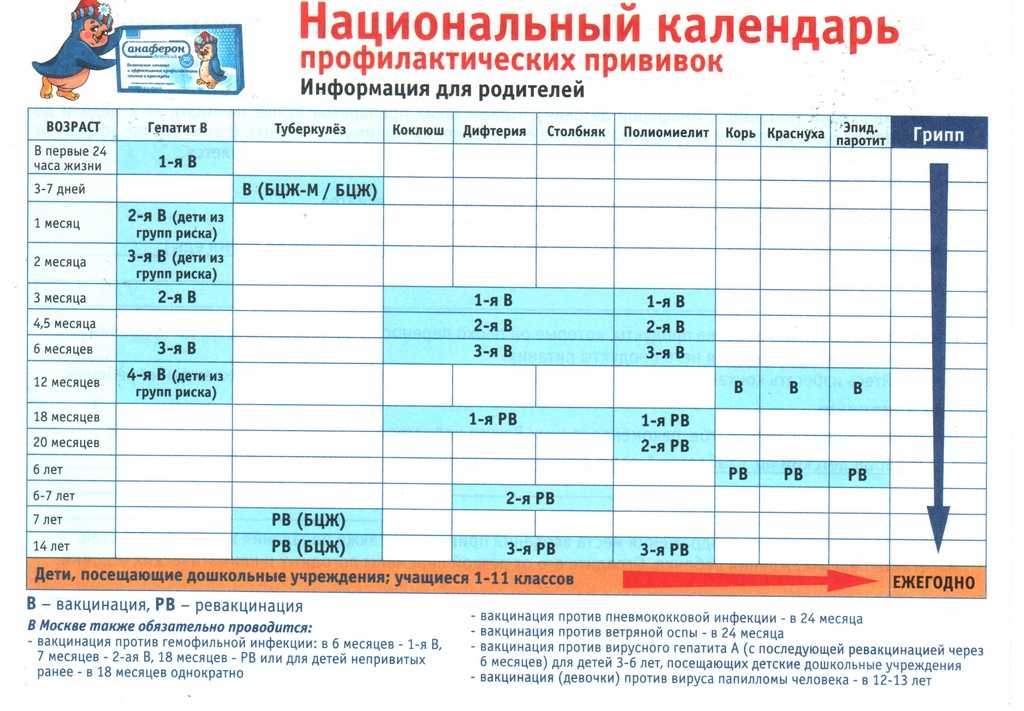
Методы поиска:
Мы провели поиск в базах данных CENTRAL (2013, выпуск 12), MEDLINE (с 1950 года до 2 недели января 2014 года), EMBASE (с 1974 года до января 2014 года), Biosis Previews (с 2009 года до января 2014 года) и CINAHL (с 2009 года до января 2014 года).
Критерии отбора:
Мы отобрали двойные слепые рандомизированные испытания по оценке эффективности и безопасности бесклеточных вакцин у детей в возрасте до шести лет, с активным последующим наблюдением за участниками и лабораторным подтверждением случаев коклюша.
Сбор и анализ данных:
Два автора обзора независимо извлекали данные и оценивали риск смещения в исследованиях. Различия в дизайне клинических испытаний не позволили сделать мета-анализ данных по эффективности. Мы объединили данные по безопасности из отдельных клинических испытаний, используя модель случайных эффектов мета-анализа.
Основные результаты:
Мы включили 6 клинических испытаний по оценке эффективности с общим числом участников 46283 и 52 клинических испытания по оценке безопасности с общим числом участников 136541. Большинство клинических испытаний по безопасности не сообщали о методах генерации случайных последовательностей, сокрытия распределения и ослепления, что создает затруднения при оценке риска смещения в этих исследованиях. Эффективность мульти-компонентных (≥3) вакцин варьировала от 84% до 85% в предотвращении типичного коклюша (характеризующегося приступами кашля в течение 21 или более последовательных дней с подтверждением B.pertussis инфекции культуральными, соответствующими серологическими методами или контактом с членом семьи, который имеет культурально-подтвержденный коклюш), и от 71% до 78% в профилактике легкой формы коклюша (характеризующейся 7 или более последовательных дней кашля с подтверждением B.pertussis инфекции культуральными или соответствующими серологическими методами). В противоположность этому, эффективность одно- и двухкомпонентных вакцин варьировала от 59% до 78% против типичного коклюша и от 41% до 58% против легкой формы коклюша. Мульти-компонентные бесклеточные вакцины более эффективны, чем низко-эффективные цельноклеточные вакцины, но могут быть менее эффективными, чем высоко-эффективные цельноклеточные вакцины.
Большинство клинических испытаний по безопасности не сообщали о методах генерации случайных последовательностей, сокрытия распределения и ослепления, что создает затруднения при оценке риска смещения в этих исследованиях. Эффективность мульти-компонентных (≥3) вакцин варьировала от 84% до 85% в предотвращении типичного коклюша (характеризующегося приступами кашля в течение 21 или более последовательных дней с подтверждением B.pertussis инфекции культуральными, соответствующими серологическими методами или контактом с членом семьи, который имеет культурально-подтвержденный коклюш), и от 71% до 78% в профилактике легкой формы коклюша (характеризующейся 7 или более последовательных дней кашля с подтверждением B.pertussis инфекции культуральными или соответствующими серологическими методами). В противоположность этому, эффективность одно- и двухкомпонентных вакцин варьировала от 59% до 78% против типичного коклюша и от 41% до 58% против легкой формы коклюша. Мульти-компонентные бесклеточные вакцины более эффективны, чем низко-эффективные цельноклеточные вакцины, но могут быть менее эффективными, чем высоко-эффективные цельноклеточные вакцины. Большинство системных и локальных побочных эффектов были существенно менее распространены при использовании бесклеточных вакцин, чем при использовании цельноклеточных вакцин как при введении первичных доз, так и при введении бустер-доз (ревакцинации).
Большинство системных и локальных побочных эффектов были существенно менее распространены при использовании бесклеточных вакцин, чем при использовании цельноклеточных вакцин как при введении первичных доз, так и при введении бустер-доз (ревакцинации).
Заметки по переводу:
Перевод: Юдина Екатерина Викторовна. Редактирование: Зиганшина Лилия Евгеньевна. Координация проекта по переводу на русский язык: Казанский федеральный университет. По вопросам, связанным с этим переводом, пожалуйста, свяжитесь с нами по адресу: [email protected]
Исходы у младенцев после введения вакцины Tdap во время беременности: обсервационное исследование
Текст статьи
Меню статьи
- Статья
Текст - Артикул
информация - Цитата
Инструменты - Поделиться
- Быстрое реагирование
- Артикул
метрика - Оповещения
Педиатрия
Исследования
Infant outcomes after exposure to Tdap vaccine in pregnancy: an observational study
- Tony Walls1,
- Patricia Graham1,2,
- Helen Petousis-Harris3,
- Linda Hill4,
- Nicola Austin1,2
- 1 Кафедра педиатрии Университета Отаго, Крайстчерч, Новая Зеландия
- 2 Районный совет здравоохранения Кентербери, Крайстчерч, Новая Зеландия
- 3 Кафедра общей практики и первичной медико-санитарной помощи Оклендского университета, Окленд, Новая Зеландия
- 4 Центр последипломного обучения сестринскому делу, Университет Отаго, Крайстчерч, Новая Зеландия
- доктор Тони Уоллс; tony.
 walls{at}otago.ac.nz
walls{at}otago.ac.nz
Abstract
Цель Вакцинация против коклюша во время беременности недавно была рекомендована как в США, так и в Великобритании для предотвращения коклюшной инфекции у младенцев. Несмотря на отсутствие явных опасений по поводу безопасности введения вакцины Tdap во время беременности, имеются лишь ограниченные данные о безопасности. Мы стремились внимательно следить за детьми, подвергшимися воздействию Tdap во время беременности, чтобы выявить любые неблагоприятные последствия, которые могут быть связаны с вакциной.
Дизайн Это было проспективное обсервационное исследование, в ходе которого собиралась информация для оценки безопасности вакцины Tdap для младенцев, подвергшихся воздействию вакцины во время беременности. Младенцы наблюдались в течение от 6 до 12 месяцев после рождения, при этом 84% завершили 12 месяцев наблюдения. Информация была получена из объективных источников, включая регулярные визиты к врачу и записи о прививках, где это возможно, а также частые отчеты родителей.
Настройка Район Кентербери в Новой Зеландии.
Пациенты Группа из 403 младенцев, матери которых получили вакцину Tdap.
Основные показатели исхода Гестационный возраст при рождении, параметры роста, врожденные аномалии, статус иммунизации и своевременность иммунизации, развитие коклюшной инфекции.
Результаты Не было никаких существенных различий в массе тела при рождении, гестационном возрасте при рождении, врожденных аномалиях или росте младенцев по сравнению с исходными данными о населении. Младенцы матерей, получивших вакцину, с большей вероятностью получали прививки вовремя в младенчестве. В этой когорте не было случаев коклюша, несмотря на высокий уровень заболеваемости среди населения. Мы не обнаружили каких-либо побочных эффектов, связанных с воздействием вакцины.
Выводы Эти данные дополняют растущее количество доказательств того, что введение вакцины Tdap во время беременности является подходящей стратегией для снижения бремени коклюша у младенцев.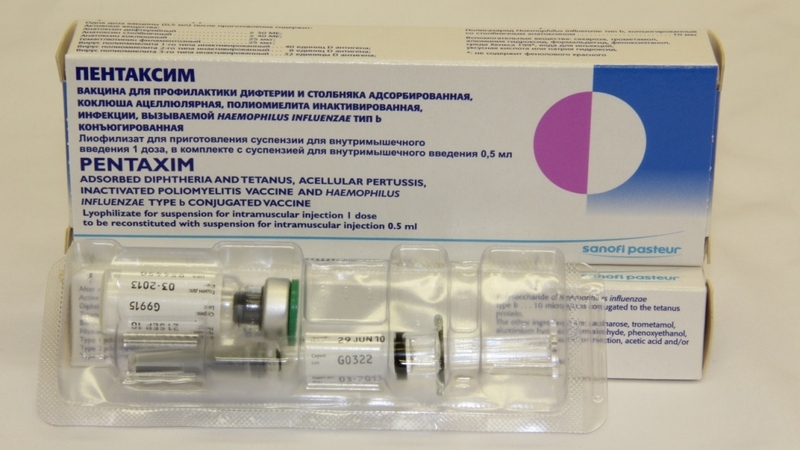
Регистрация клинических испытаний Австралия Новая Зеландия Реестр клинических испытаний ACTRN12613001045707.
- ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ
- ОБЩЕСТВЕННОЕ ЗДРАВООХРАНЕНИЕ
Это статья с открытым доступом, распространяемая в соответствии с некоммерческой лицензией Creative Commons Attribution (CC BY-NC 4.0), которая разрешает другим распространять, ремикшировать, адаптировать, строить на ее основе работать в некоммерческих целях и лицензировать свои производные работы на других условиях, при условии, что оригинальная работа правильно процитирована и использование является некоммерческим. См.: http://creativecommons.org/licenses/by-nc/4.0/
http://dx.doi.org/10.1136/bmjopen-2015-009536
Статистика с сайта Altmetric.com
Запрос разрешений
направит вас к службе RightsLink Центра защиты авторских прав. Вы сможете получить быструю цену и мгновенное разрешение на повторное использование контента различными способами.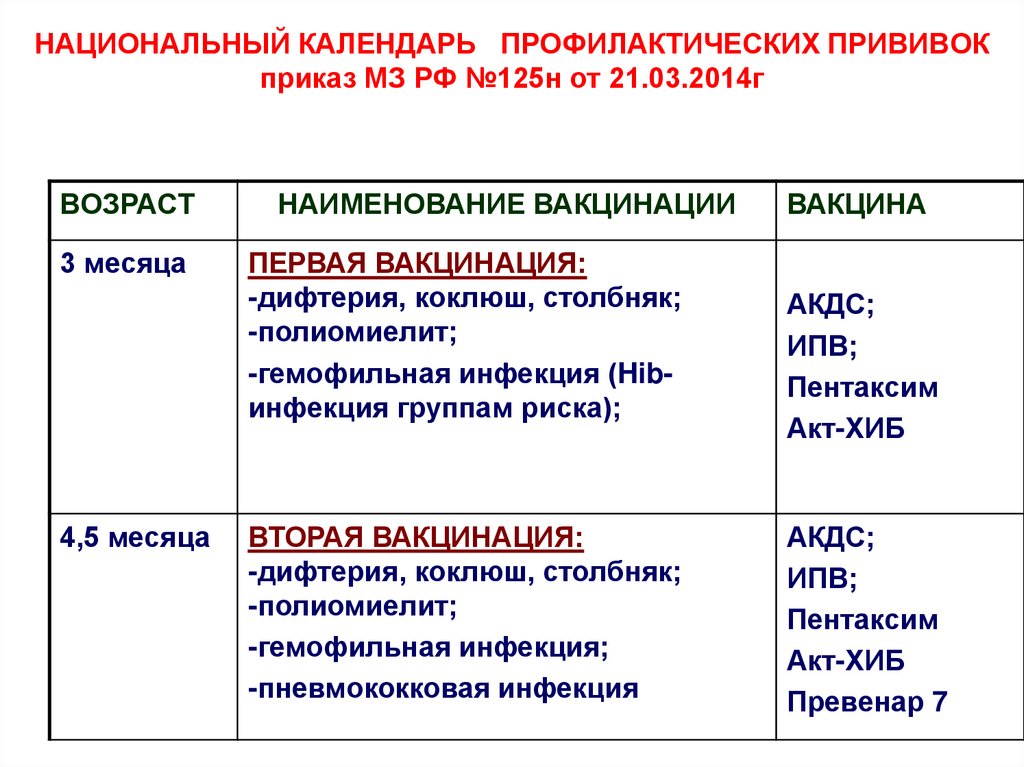
- ИНФЕКЦИОННЫЕ ЗАБОЛЕВАНИЯ
- ОБЩЕСТВЕННОЕ ЗДРАВООХРАНЕНИЕ
Сильные стороны и ограничения данного исследования
Мы часто контактировали с родителями, чтобы определить неблагоприятные события, используя различные способы общения.
Везде, где это было возможно, показатели состояния здоровья младенцев были получены из объективных исходных данных.
Наша исследуемая популяция вряд ли будет действительно репрезентативной для общей популяции из-за наших методов набора.
Мы не включили группу сравнения младенцев, не подвергшихся вакцинации во время беременности.
Введение
Младенцы раннего возраста подвергаются наибольшему риску осложнений от коклюша в случае его заражения. В отсутствие материнской иммунизации младенцы в возрасте до 2 месяцев, как правило, не защищены от коклюша до тех пор, пока их не вакцинируют, так как через плаценту переносится мало защитных антител или они вообще не переносятся. Это связано с относительно низкими титрами антител у большинства беременных женщин, поскольку в целом происходит активный плацентарный перенос материнских коклюшных антител, что приводит к более высоким уровням коклюшно-специфических IgG у младенцев, чем у матери.1 В 2012 г. Консультативный комитет США по практике иммунизации (ACIP) рекомендовал вводить бесклеточную коклюшную вакцину (Tdap) любому лицу, которое может быть в контакте с младенцами в возрасте до 12 месяцев, включая беременных женщин, независимо от предыдущей вакцинации Tdap2. Аналогичным образом, в 2012 г. Комитет по вакцинации и иммунизации Великобритании согласился ввести программу иммунизации женщин с Tdap на более поздних сроках беременности.3 Рекомендуется введение вакцины беременным женщинам, поскольку она не только защищает мать от коклюша, но и индуцирует антитела. которые передаются младенцу до рождения и обеспечивают защиту в течение первых недель жизни2. ACIP признал, что безопасность Tdap imm унификация во время беременности систематически не изучалась, а единственные доступные данные получены из небольших исследований, постмаркетингового наблюдения и Системы отчетности о побочных эффектах вакцин (VAERS) США.
Это связано с относительно низкими титрами антител у большинства беременных женщин, поскольку в целом происходит активный плацентарный перенос материнских коклюшных антител, что приводит к более высоким уровням коклюшно-специфических IgG у младенцев, чем у матери.1 В 2012 г. Консультативный комитет США по практике иммунизации (ACIP) рекомендовал вводить бесклеточную коклюшную вакцину (Tdap) любому лицу, которое может быть в контакте с младенцами в возрасте до 12 месяцев, включая беременных женщин, независимо от предыдущей вакцинации Tdap2. Аналогичным образом, в 2012 г. Комитет по вакцинации и иммунизации Великобритании согласился ввести программу иммунизации женщин с Tdap на более поздних сроках беременности.3 Рекомендуется введение вакцины беременным женщинам, поскольку она не только защищает мать от коклюша, но и индуцирует антитела. которые передаются младенцу до рождения и обеспечивают защиту в течение первых недель жизни2. ACIP признал, что безопасность Tdap imm унификация во время беременности систематически не изучалась, а единственные доступные данные получены из небольших исследований, постмаркетингового наблюдения и Системы отчетности о побочных эффектах вакцин (VAERS) США.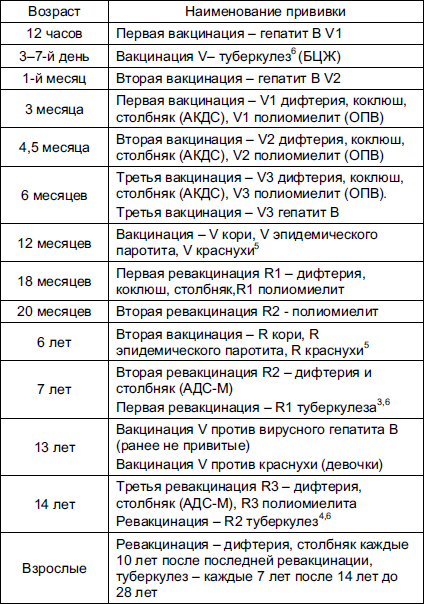 4 Они пришли к выводу, что «имеющиеся данные этих исследований не предполагают какой-либо повышенной частоты или необычные модели побочных эффектов у беременных женщин, получивших Tdap, и что несколько серьезных побочных эффектов, о которых сообщалось, вряд ли были вызваны вакциной».
4 Они пришли к выводу, что «имеющиеся данные этих исследований не предполагают какой-либо повышенной частоты или необычные модели побочных эффектов у беременных женщин, получивших Tdap, и что несколько серьезных побочных эффектов, о которых сообщалось, вряд ли были вызваны вакциной».
В небольшом рандомизированном контролируемом исследовании (РКИ) фазы 1–2 Munoz et al 5 продемонстрировали, что вакцину Tdap можно безопасно вводить женщинам во время беременности без значительных побочных эффектов у матери или ребенка. В исследование были включены 33 младенца, подвергшихся внутриутробному воздействию вакцины Tdap. Учитывая трудности, связанные с клиническими испытаниями вакцин, вводимых во время беременности, маловероятно, что будут проведены достаточно мощные РКИ для оценки безопасности вакцины Tdap. Поэтому мы полагаемся на постепенное накопление данных небольших испытаний и обсервационных исследований.
Целью данного исследования было описание любых нежелательных явлений после иммунизации, связанных с введением вакцины Tdap во время беременности, с акцентом на исходы у младенцев.
Пациенты и методы
Календарь иммунизации Новой Зеландии (НЗ) включает в себя трехдозовый календарь бесклеточной коклюшной вакцины, вводимой детям в возрасте 6 недель, 3 и 5 месяцев, с ревакцинацией в возрасте 4 и 11 лет. В ответ на недавнюю эпидемию коклюша в Новой Зеландии в 2012 году Министерство здравоохранения ввело вакцину Tdap во время беременности для женщин в сроке от 28 до 38 недель беременности. Финансируемой вакциной была Boostrix (GSK). В Новой Зеландии все прививки предоставляются родителям бесплатно через врачей общей практики (ВОП) и регистрируются в Национальном регистре иммунизации (NIR). В период с октября по декабрь 2014 г. национальные показатели охвата иммунизацией составили 94% для обоих младенцев в возрасте 8 и 24 месяцев6. год). Он является частью более крупного общенационального исследования, посвященного неблагоприятным событиям после вакцинации Tdap во время беременности, и уделяет особое внимание лонгитюдным исходам у младенцев.
Женщины были включены в исследование, если они получили вакцину Tdap между 28 и 38 неделями беременности. Они должны были соблюдать стандартную дородовую помощь, включая как минимум одно ультразвуковое исследование на ранних сроках беременности. Это должно было гарантировать, что любые серьезные врожденные аномалии, выявленные на ранних сроках беременности, не будут позже связаны с вакцинацией. Мы исключили женщин, плод которых имел врожденные аномалии, тяжелые структурные и/или хромосомные аномалии, выявленные в ходе пренатального скрининга.
Они должны были соблюдать стандартную дородовую помощь, включая как минимум одно ультразвуковое исследование на ранних сроках беременности. Это должно было гарантировать, что любые серьезные врожденные аномалии, выявленные на ранних сроках беременности, не будут позже связаны с вакцинацией. Мы исключили женщин, плод которых имел врожденные аномалии, тяжелые структурные и/или хромосомные аномалии, выявленные в ходе пренатального скрининга.
Женщины заполнили форму согласия со своим терапевтом перед введением Tdap, спросив, согласны ли они с тем, что исследовательская группа свяжется с ними. Заявления врачей общей практики о возмещении расходов использовались для выявления женщин, получивших вакцину, и с теми, кто дал согласие, связывались по телефону в течение 2 недель после введения. Наблюдение за младенцами планировалось до 1 года. Первая регистрация была проведена в сентябре 2012 г., а последующее наблюдение за младенцами продолжалось до ноября 2014 г.
16 сентября 2103 г. исследованию был присвоен универсальный номер исследования (U1111-1148-0718) и оно было зарегистрировано в Реестре клинических испытаний Австралии и Новой Зеландии ( ACTRN12613001045707) от 19Сентябрь 2013 г.
исследованию был присвоен универсальный номер исследования (U1111-1148-0718) и оно было зарегистрировано в Реестре клинических испытаний Австралии и Новой Зеландии ( ACTRN12613001045707) от 19Сентябрь 2013 г.
Финансирование осуществлялось за счет неограниченного гранта Кентерберийского окружного совета здравоохранения.
Информация о беременности и исходах у младенцев была собрана из рассказов матерей и подтверждена различными объективными источниками, включая записи о рождении, заметки ведущей акушерки (LMC; главный медицинский работник, ответственный за новорожденного до 6 недельного возраста) и рутинные Младенческий 6-недельный осмотр у врача общей практики. К ним относятся любые неблагоприятные события у женщин во время беременности, гестационный возраст младенцев при рождении, масса тела при рождении, длина тела и окружность головы, врожденные аномалии и любые события, связанные с медицинским обслуживанием младенцев после рождения.
Гестационный возраст определяли по последнему менструальному периоду, а там, где он был недоступен, для его оценки использовали УЗИ на ранних сроках беременности. Преждевременные роды определялись как любой ребенок, рожденный до 37 недель гестации, а дети, рожденные <32 недель гестации, определялись как очень недоношенные. Низкая масса тела при рождении определялась как <2500 г с очень низкой массой тела при рождении <1500 г, независимо от гестационного возраста при рождении. Консенсусный список Брайтонского сотрудничества терминов и определений ключевых событий для мониторинга иммунизации во время беременности использовался для классификации значимых медицинских событий и врожденных аномалий.7
Преждевременные роды определялись как любой ребенок, рожденный до 37 недель гестации, а дети, рожденные <32 недель гестации, определялись как очень недоношенные. Низкая масса тела при рождении определялась как <2500 г с очень низкой массой тела при рождении <1500 г, независимо от гестационного возраста при рождении. Консенсусный список Брайтонского сотрудничества терминов и определений ключевых событий для мониторинга иммунизации во время беременности использовался для классификации значимых медицинских событий и врожденных аномалий.7
Данные об иммунизации младенцев были получены из NIR6, и мы задокументировали как получение вакцины, так и своевременность вакцинации. Своевременная иммунизация определялась как вакцинация младенца в течение 1 месяца от рекомендованной даты. Параметры роста младенцев были получены во время рутинных посещений клиник по уходу за детьми по месту жительства (Plunket Nurse) вплоть до посещения в возрасте около 5–7 месяцев.
Все эти услуги бесплатно предоставляются семьям в рамках плановой медицинской помощи младенцам. Z-показатели использовались для всех измерений роста, где это уместно, с использованием диаграмм роста ВОЗ.
Z-показатели использовались для всех измерений роста, где это уместно, с использованием диаграмм роста ВОЗ.
Ежемесячно матерям рассылали анкету по почте, электронной почте или смс, в которой спрашивали, были ли младенцы в тесном контакте с кем-либо с доказанной коклюшной инфекцией или необъяснимым кашлем, продолжающимся > 2 недель, или если у ребенка был стойкий кашель продолжительностью >10 дней. В каждом случае было предпринято не менее трех попыток связаться с родителями, используя несколько методов контакта, чтобы обеспечить полное последующее наблюдение за младенцами. Клинический осмотр был организован для любого ребенка, имевшего значительный контакт с больным коклюшем или симптомами, характерными для коклюша. Подробная информация о любых медицинских осмотрах, необходимых детям и не проведенных исследовательским персоналом, была получена из больничных или семейных записей.
Сообщения о серьезных нежелательных явлениях, которые наблюдались с медицинской точки зрения у матери или их младенцев, были зарегистрированы в Центре мониторинга побочных реакций при Новозеландском центре фармакологического надзора Университета Отаго.
Это описательный анализ, и результаты представлены в цифрах и процентах. Было проведено сравнение показателей и своевременности иммунизации младенцев между изучаемой популяцией и общей популяцией младенцев региона Кентербери в течение периода исследования с использованием коэффициентов риска.
Результаты
Мы были уведомлены о 1211 женщинах, получивших вакцину Tdap во время беременности, и набрали 470 человек. Причины отказа от участия перечислены на рисунке 1. Средний возраст женщин на момент вакцинации Tdap составлял 32 года (диапазон 15 лет). –45 лет), а средний срок беременности составил 33,9 недель. Восемьдесят шесть процентов женщин были европейками Новой Зеландии, из них 4% маори и 8% азиатки. Шестьдесят две женщины также получили трехвалентную вакцину против гриппа во время беременности, часто одновременно с вакциной Tdap.
Рисунок 1
Зачисление в исследование (FU, последующее наблюдение).
Последующие данные были получены от 403 женщин и 408 младенцев (403 одноплодных, 6 близнецов и 1 мертворожденный), 345 из них в возрасте до 12 месяцев и 63 — в возрасте до 6–12 месяцев. Мы решили включить в анализ младенцев, наблюдавшихся как минимум до 6 месяцев, так как мы чувствовали, что к этому времени должно произойти большинство значимых с медицинской точки зрения событий, связанных с материнской вакцинацией. В 67 случаях были доступны только материнские данные, которые не были включены в анализ. Из исследования было исключено 28 младенцев.
Мы решили включить в анализ младенцев, наблюдавшихся как минимум до 6 месяцев, так как мы чувствовали, что к этому времени должно произойти большинство значимых с медицинской точки зрения событий, связанных с материнской вакцинацией. В 67 случаях были доступны только материнские данные, которые не были включены в анализ. Из исследования было исключено 28 младенцев.
Триста восемьдесят пять наблюдаемых новорожденных родились в срок (94%). Средний гестационный возраст при родах составлял 39,2 недели (диапазон 33–42 недели). Было шесть пар близнецов (3 пары родились в срок, 2 пары родились на 36 неделях и 1 на 33 неделях беременности). Только 23 (6%) младенца родились на сроке менее 37 недель беременности. Средняя масса тела при рождении составила 3490 г, только один ребенок весил <1500 г и восемь младенцев весили от 1500 до 2500 г.
У десяти младенцев (2,5%) были выявлены значимые медицинские осложнения или врожденные аномалии, перечисленные в таблице 1. Один младенец родился мертвым (0,2%), и, несмотря на патологоанатомическое исследование (врожденных аномалий выявлено не было), причина этого неизвестно. В анамнезе у матери были мертворождения.
В анамнезе у матери были мертворождения.
Вставка 1
Медицинские события и врожденные аномалии у детей, подвергшихся воздействию TDAP во время беременности
Gastroschisis
Малротация кишечника
СОЗДАНИЯ НОВАЛА.
Дисплазия тазобедренного сустава
Аномалия правой руки
Ларингомаляция
В общей сложности 303 ребенка завершили 6-недельный осмотр, а 278 — 5-месячный. На рисунке 2 показаны z-показатели массы тела при рождении, при 6-недельной проверке и в возрасте от 5 до 7 месяцев, каждый из которых имеет нормальное распределение.
Рисунок 2
Z-показатели массы тела младенцев при рождении, в возрасте 6 недель и 5–7 месяцев.
Только девять младенцев имели контакт с подтвержденным случаем коклюша в течение периода наблюдения. Шестьдесят семь младенцев находились в домашнем контакте с человеком с длительным кашлем, и, как сообщается, у 64 младенцев кашель длился более 10 дней. Ни у одного из этих младенцев впоследствии не был диагностирован коклюш. Только девять младенцев были госпитализированы в течение периода наблюдения. У троих из них было заболевание дыхательных путей, у одного из них была доказана инфекция гриппа, и все трое дали отрицательный результат на коклюш.
Ни у одного из этих младенцев впоследствии не был диагностирован коклюш. Только девять младенцев были госпитализированы в течение периода наблюдения. У троих из них было заболевание дыхательных путей, у одного из них была доказана инфекция гриппа, и все трое дали отрицательный результат на коклюш.
Доля младенцев в когорте SMART VIP, получивших своевременную иммунизацию, составила 97,8%, 98,5% и 94,2% в возрасте 6 недель, 3 и 5 месяцев соответственно. Для каждого события вакцинации это было значительно лучше, чем для всей когорты младенцев Кентербери за тот же период времени (таблица 1). Таблица 10003
Обсуждение
Несмотря на широкое применение вакцины Tdap во время беременности, данные о безопасности ее применения во время беременности все еще ограничены. На сегодняшний день это крупнейшее исследование, посвященное изучению индивидуальных последствий для здоровья и проспективному мониторингу нежелательных явлений у младенцев, чьи матери получали вакцину Tdap во время беременности./90/90.jpg)
В этом исследовании изучались исходы у младенцев, и не было обнаружено доказательств увеличения числа побочных эффектов у младенцев, подвергшихся внутриутробному воздействию вакцины Tdap, по сравнению с исходными показателями в популяции. Исходы родов, параметры роста и частота врожденных аномалий были очень похожи на исходные показатели в Новой Зеландии. В отчете Министерства здравоохранения Новой Зеландии о клинических показателях родовспоможения8 сообщается, что 8% всех живых младенцев рождаются между 32 и 36 неделями беременности в регионе Кентербери. Это было выше, чем 6% уровень недоношенности в нашей когорте.
В реестре врожденных пороков Новой Зеландии9 указана частота врожденных аномалий в диапазоне от 4000 до 6000 на 100 000 родов в больнице (от 4% до 6%) за 2000–2012 годы. В нашей когорте показатели были значительно ниже этого показателя — 2,7%. Эти сравнения следует проводить с осторожностью, учитывая избирательный характер нашей исследуемой популяции. В частности, вполне вероятно, что частота врожденных аномалий в нашей исследуемой популяции будет ниже, чем сравнительные данные, учитывая, что наша когорта не включала младенцев, родившихся до 33 недель беременности. Тем не менее, обнадеживает тот факт, что эти данные не указывают на потенциальные неблагоприятные последствия.
Тем не менее, обнадеживает тот факт, что эти данные не указывают на потенциальные неблагоприятные последствия.
Единственным исходом для младенцев, который значительно отличался в нашей когорте от популяции младенцев в Кентербери, была своевременность иммунизации младенцев. Своевременная иммунизация детей раннего возраста является одним из ключевых мероприятий общественного здравоохранения, рекомендуемых для снижения риска заболевания коклюшем у детей раннего возраста во время эпидемии. Отсроченная иммунизация неоднократно ассоциировалась с более высокими показателями заболеваемости коклюшем у младенцев и госпитализаций по поводу коклюша.10
Младенцы, рожденные от матерей из нашей когорты, получивших вакцину Tdap, с большей вероятностью получали вакцины вовремя по сравнению с показателями населения Кентербери. Одно из возможных объяснений этого заключается в том, что женщины, которые решили пройти вакцинацию и согласились участвовать в исследовании, были лучше осведомлены о продолжающейся эпидемии коклюша в обществе и, следовательно, с большей вероятностью решат вовремя вакцинировать своих детей. В Новой Зеландии большинство LMC являются акушерками, которые не могут вводить вакцины. Если женщины хотят пройти вакцинацию, они должны посетить своего врача общей практики, что не является обычной частью дородового наблюдения. Этот дополнительный визит к врачу общей практики даст возможность обсудить преимущества иммунизации как для них самих, так и для их детей с практикующим врачом. Внедрение вакцины могло непреднамеренно привести к большему количеству контактов будущих матерей со своими врачами и большему количеству дискуссий об иммунизации.
В Новой Зеландии большинство LMC являются акушерками, которые не могут вводить вакцины. Если женщины хотят пройти вакцинацию, они должны посетить своего врача общей практики, что не является обычной частью дородового наблюдения. Этот дополнительный визит к врачу общей практики даст возможность обсудить преимущества иммунизации как для них самих, так и для их детей с практикующим врачом. Внедрение вакцины могло непреднамеренно привести к большему количеству контактов будущих матерей со своими врачами и большему количеству дискуссий об иммунизации.
В общем, нет никаких теоретических проблем безопасности при введении субъединичных вакцин беременным женщинам. Некоторые вакцины, такие как вакцина против столбняка, широко используются в этой группе без признаков серьезных побочных эффектов у матери или ребенка.11 Сроки иммунизации матери также являются важным фактором безопасности вакцины. Когда вакцина Tdap вводится между 28 и 38 неделями беременности, риск врожденных аномалий, вероятно, будет низким, учитывая, что период основного эмбриогенеза плода был завершен к этой беременности. Однако по сравнению с вакцинами, вводимыми вне беременности, данные о безопасности часто ограничены из-за отсутствия крупных РКИ для их оценки. В отсутствие данных РКИ накопление информации из хорошо спланированных обсервационных исследований становится все более важным. Это исследование расширяет наши знания о безопасности вакцины Tdap, вводимой во время беременности, и мы согласились включить данные исследования в международную базу данных о воздействии Tdap во время беременности.
Однако по сравнению с вакцинами, вводимыми вне беременности, данные о безопасности часто ограничены из-за отсутствия крупных РКИ для их оценки. В отсутствие данных РКИ накопление информации из хорошо спланированных обсервационных исследований становится все более важным. Это исследование расширяет наши знания о безопасности вакцины Tdap, вводимой во время беременности, и мы согласились включить данные исследования в международную базу данных о воздействии Tdap во время беременности.
Недавние оценки эффективности вакцины показывают, что вакцинация женщин в конце третьего триместра беременности на 91% защищает от коклюша у младенцев в первые 2 месяца жизни.12,13 Ни у одного из младенцев в нашей когорте не развился коклюш. Это было обсервационное исследование, в котором участвовали только младенцы, подвергшиеся вакцинации, поэтому мы не можем делать какие-либо выводы об эффективности вакцины. Однако, учитывая высокие показатели заболеваемости коклюшем в сообществе на протяжении всего исследования, очень обнадеживает тот факт, что случаев заболевания не было. Это согласуется с предполагаемой эффективностью вакцины.
Это согласуется с предполагаемой эффективностью вакцины.
Одной из сильных сторон этого исследования было то, что благодаря частым контактам с родителями с использованием различных способов общения у нас было большое количество младенцев, завершивших последующее наблюдение. Мы решили использовать объективные показатели данных из обычных источников, таких как NIR, чтобы обеспечить оптимальное качество данных.
Несмотря на то, что мы смогли получить данные о большом количестве женщин и младенцев, однако план наблюдения означал, что наша выборка не является действительно репрезентативной для всего населения в регионе. Например, в нашей когорте было меньше женщин маори и женщин с тихоокеанских островов, чем в остальной части Кентербери, и было показано, что в обеих этих этнических группах показатели заболеваемости коклюшем значительно выше, чем среди европейцев Новой Зеландии.14 Мы также должны подчеркнуть, что женщины К участию в этом исследовании подошла подгруппа вакцинированных, давших согласие на то, чтобы исследовательская группа связалась с ними. Из-за нехватки ресурсов мы не смогли связаться со всеми этими женщинами, и, к сожалению, у нас нет данных для сравнения вакцинированных женщин, которые не участвовали в исследовании, с нашей исследуемой популяцией.
Из-за нехватки ресурсов мы не смогли связаться со всеми этими женщинами, и, к сожалению, у нас нет данных для сравнения вакцинированных женщин, которые не участвовали в исследовании, с нашей исследуемой популяцией.
Небольшая часть женщин в этом исследовании также получила вакцину против сезонного гриппа, часто одновременно с вакциной Tdap. Учитывая наблюдательный характер исследования, мы не могли это контролировать; однако не было статистически значимых различий в результатах для женщин, получивших обе вакцины, по сравнению с теми, кто не получил противогриппозную вакцину (данные не представлены).
Наконец, несмотря на то, что это крупнейшее на сегодняшний день исследование с подробным наблюдением за младенцами, подвергшимися воздействию вакцины Tdap во время беременности, число участников все еще слишком мало, чтобы выявить менее распространенные побочные эффекты, связанные с вакциной.
Выводы
Ранее было показано, что введение вакцины Tdap во время беременности обеспечивает защиту младенцев от коклюша во время эпидемий. Мы не показали различий в исходах у младенцев у тех, кто подвергся воздействию вакцины во время беременности, по сравнению с населением в целом. Это дает дополнительные доказательства, подтверждающие рекомендации по вакцинации беременных женщин Tdap для предотвращения коклюша у их детей. Однако данные о безопасности вакцины остаются ограниченными, и сохраняется необходимость в постоянном наблюдении и отчетности о нежелательных явлениях, связанных с вакцинацией Tdap во время беременности.
Мы не показали различий в исходах у младенцев у тех, кто подвергся воздействию вакцины во время беременности, по сравнению с населением в целом. Это дает дополнительные доказательства, подтверждающие рекомендации по вакцинации беременных женщин Tdap для предотвращения коклюша у их детей. Однако данные о безопасности вакцины остаются ограниченными, и сохраняется необходимость в постоянном наблюдении и отчетности о нежелательных явлениях, связанных с вакцинацией Tdap во время беременности.
Благодарности
Авторы благодарят доктора Джонатана Уиллимана за советы по статистическому анализу. Они также благодарят CDHB за финансовую поддержку этого исследования.
Ссылки
- ↵
- Healy CM,
- Munoz FM,
- Rench MA, и др.
. Распространенность коклюшных антител в материнских родах, пуповине и детской сыворотке. J Infect Dis 2004;190:335–40. дои: 10.1086/421033
- ↵
Центры по контролю и профилактике заболеваний CDC.
 Обновленные рекомендации по использованию противостолбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной коклюшной вакцины (Tdap) у беременных женщин — Консультативный комитет по практике иммунизации (ACIP), 2012 г. MMWR Morb Mortal Wkly Rep 2013; 62:131–5.
Обновленные рекомендации по использованию противостолбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной коклюшной вакцины (Tdap) у беременных женщин — Консультативный комитет по практике иммунизации (ACIP), 2012 г. MMWR Morb Mortal Wkly Rep 2013; 62:131–5. - ↵
Заседание JCVI по иммунизации против коклюша: август 2012 г. https://www.gov.uk/government/groups/joint-committee-on-vaccination-and-immunisation
- ↵
- Жетеева Ю.А.,
- Моро П.Л.,
- Теппер Н.К. и др.
. Сообщения о нежелательных явлениях после введения столбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной вакцины против коклюша у беременных женщин. Am J Obstet Gynecol 2012;207:59.e1–7. doi:10.1016/j.ajog.2012.05.006
- ↵
- Munoz FM,
- Bond NH,
- Maccato M, et al
1
.
 Безопасность и иммуногенность иммунизации против столбняка, дифтерии и бесклеточного коклюша (Tdap) во время беременности у матерей и младенцев: рандомизированное клиническое исследование. JAMA 2014; 311:1760–9. doi:10.1001/jama.2014.3633
Безопасность и иммуногенность иммунизации против столбняка, дифтерии и бесклеточного коклюша (Tdap) во время беременности у матерей и младенцев: рандомизированное клиническое исследование. JAMA 2014; 311:1760–9. doi:10.1001/jama.2014.3633 - ↵
Публикации Национального регистра иммунизации. http://www.health.govt.nz/our-work/preventative-health-wellness/immunisation/national-immunisation-register/national-immunisation-register-publications (по состоянию на 9 марта 2015 г.).
- ↵
- Муньос Ф.М.,
- Эккерт Л.О.,
- Кац М.А. и др.
. Ключевые термины для оценки безопасности вакцин при беременности: результаты глобального консультативного процесса по инициированию гармонизации определений нежелательных явлений. Вакцина 2015;33:6441–52. doi:10.1016/j.vaccine.2015.07.112
- ↵
Клинические показатели родовспоможения Новой Зеландии.
 http://www.health.govt.nz/publication/new-zealand-maternity-clinical-indicators-2012 (по состоянию на 9 марта 2015 г.).
http://www.health.govt.nz/publication/new-zealand-maternity-clinical-indicators-2012 (по состоянию на 9 марта 2015 г.). - ↵
Реестр врожденных дефектов Новой Зеландии. http://nzbdr.ac.nz (по состоянию на 9 марта 2015 г.).
- ↵
- Grant CC,
- Roberts M,
- Scragg R, et al
. Отсроченная иммунизация и риск коклюша у младенцев: непревзойденное исследование случай-контроль. BMJ 2003;326:852–3. doi:10.1136/bmj.326.7394.852
- ↵
- Линдси Б,
- Кампманн Б,
- Джонс С
. Иммунизация матери как стратегия снижения восприимчивости к инфекциям у новорожденных. Curr Opin Infect Dis 2013;26:248–53. doi: 10.1097/QCO.0b013e3283607a58
- ↵
- Амирталингам Г.,
- Эндрюс Н.,
- Кэмпбелл Х. и др.
.
 Эффективность материнской вакцинации против коклюша в Англии: обсервационное исследование. Ланцет 2014; 384:1521–8. doi:10.1016/S0140-6736(14)60686-3
Эффективность материнской вакцинации против коклюша в Англии: обсервационное исследование. Ланцет 2014; 384:1521–8. doi:10.1016/S0140-6736(14)60686-3 - ↵
- Dabrera G,
- Amirthalingam G,
- Andrews N, et al
5
- Исследование случай-контроль для оценки эффективности вакцинации матерей против коклюша для защиты новорожденных в Англии и Уэльсе, 2012–2013 гг. Clin Infect Dis 2015;60:333–7. doi:10.1093/cid/ciu821
- ↵
- Somerville RL,
- Grant CC,
- Grimwood K, et al
. Младенцы, госпитализированные с коклюшем: оценка истинного бремени болезни. J Paediatr Child Health 2007;43:617–22. doi:10.1111/j.1440-1754.2007.01154.x
Сноски
Twitter Следите за Хелен Петусис-Харрис на @PetousisH
Авторы TW разработали концепцию и дизайн исследования, подготовили рукопись и утвердили окончательный вариант рукописи в представленном виде.
 PG разработала инструмент для сбора данных, собрала и сопоставила большую часть данных. Она помогла с составлением рукописи и одобрила окончательный вариант. HP-H участвовала в разработке и дизайне концепции исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. LH участвовала в сборе данных и анализе данных, касающихся статуса иммунизации младенцев. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. NA участвовала в планировании и разработке исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант.
PG разработала инструмент для сбора данных, собрала и сопоставила большую часть данных. Она помогла с составлением рукописи и одобрила окончательный вариант. HP-H участвовала в разработке и дизайне концепции исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. LH участвовала в сборе данных и анализе данных, касающихся статуса иммунизации младенцев. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. NA участвовала в планировании и разработке исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант.Финансирование Департамента здравоохранения округа Кентербери.
Конкурирующие интересы Компания TW провела исследования под руководством исследователей, финансируемых GSK. Компания HP-H провела исследования под руководством исследователей, финансируемых GSK, CSL и Sanofi.

Согласие пациента Получено.
Утверждение этики Верхний Юг Региональный комитет по этике — одобрение URA/12/EXP/021.
Происхождение и рецензирование Не введен в эксплуатацию; рецензируется внешними экспертами.
Заявление о совместном использовании данных Дополнительные данные отсутствуют.
Читать полный текст или скачать PDF:
Подписаться
Войти под своим именем пользователя и паролем
Пароль *
Забыли данные для входа? Зарегистрировать новую учетную запись?
Забыли имя пользователя или пароль?
прививок — Здоровье и благополучие кампуса
Google Translate
Часто задаваемые вопросы (FAQ) или Исключения или Срок приема до осени 2021 г. все студенты.
Для достижения этой всеобъемлющей цели
Калифорнийский политехнический институт и Канцелярия канцлера требуют, чтобы все поступающие студенты (первокурсники, переводные студенты и аспиранты) соответствовали требованиям иммунизации и проходили оценку риска заболевания туберкулезом в соответствии с Исполнительным приказом.
 803.
803. Учащихся просят предоставить информацию и документы о прививках через Портал здравоохранения и консультирования до первого дня занятий, чтобы избежать возможных задержек регистрации в будущем.
Однако все записи о вакцинации против COVID-19 должны быть представлены через декларацию о статусе вакцинации против COVID-19.Мы рекомендуем вам начать этот процесс как можно раньше, поскольку некоторые вакцины требуют многократных доз и могут занять шесть месяцев.
Шаги для завершения
1. Узнайте, какие прививки потребуются в зависимости от вашего возраста в первый день занятий. Вот полезный инструмент, который поможет вам.
2. Пройдите оценку риска туберкулеза.
Заполните анкету для скрининга на туберкулез на портале здравоохранения и консультирования. Этот портал находится на портале входа в систему Cal Poly.
Вы должны заполнить Анкету для скрининга на ТБ через Портал здравоохранения и консультирования (доступен после 1 мая).

Начните с заполнения Анкеты для скрининга на ТБ через Портал здравоохранения и консультирования. Тестирование на туберкулез не требуется автоматически для поступающих учащихся, поэтому, пожалуйста, не отправляйте тест на туберкулез или рентгенографию грудной клетки, если это не указано специально.
Скрининг на туберкулез содержит вопросы, на которые вы должны ответить «да» или «нет». После того как вы ответите на все вопросы, форма предоставит вам инструкции , если вам необходимо выполнить дополнительные действия.
Если вам нужна помощь в ответах на вопросы о скрининге на туберкулез или выполнении любых необходимых дополнительных действий, свяжитесь с нами по телефону 805-756-1211. Мы будем рады помочь!
При необходимости представить дополнительную документацию.
3. Сопоставьте ваши предыдущие вакцины/титры с требуемыми параметрами возраста, дозы и интервала: одним из следующих способов:
Вакциной:
- Две дозы вакцины MMR (или две дозы каждой из отдельных вакцин против кори, эпидемического паротита и краснухи).

- Дозы должны соответствовать следующим возрастным/интервалным требованиям:
- Первая доза должна быть не позднее вашего первого дня рождения
- Вторая доза должна быть по крайней мере через 28 дней после первой дозы
- Если у вас есть только одна доза, соответствующая возрасту/интервалам, вам все равно необходимо получить дополнительную дозу.
- Примечание: , так как MMR — это живая вакцина, она может быть противопоказана при определенных состояниях (в том числе при беременности).
По титру:
Титр – это анализ крови на наличие антител. Если вы действительно болели корью, эпидемическим паротитом и/или краснухой или не можете найти записи о ваших прошлых дозах вакцин, вы можете подумать о титре.
- Один титр крови на корь, эпидемический паротит и краснуху, подтверждающий наличие иммунитета к каждому из них.
- Если ваши результаты титра не свидетельствуют об иммунитете, вам все равно необходимо будет получить любые оставшиеся дозы вакцины (вакцин), как указано выше.

- Примечание: при сообщении результатов титра помните, что «положительный» означает «положительный на иммунитет», а «отрицательный» означает «отрицательный на иммунитет».
Ветряная оспа (ветрянка)
Вы можете удовлетворить потребность в ветряной оспе одним из следующих способов:
Вакциной:
- Две дозы вакцины против ветряной оспы.
- Дозы должны соответствовать следующим возрастным/интервалным требованиям:
- Первая доза должна быть не позднее ваш первый день рождения
- Вторая доза должна быть по крайней мере через 28 дней после первой дозы
- Если у вас есть только одна доза, соответствующая возрасту/интервалам, вам все равно необходимо получить дополнительную дозу.
- Примечание: поскольку ветряная оспа является живой вакциной, она может быть противопоказана при определенных состояниях (в том числе при беременности).

По титру:
Титр – это анализ крови, проверяющий наличие антител. Если вы действительно болели ветряной оспой или не можете найти записи о ваших прошлых дозах вакцин, вы можете подумать о титре.
- Титр крови на ветряную оспу, показывающий, что у вас есть иммунитет.
- Не у всех, кто болеет ветрянкой или опоясывающим лишаем, обязательно развивается иммунитет к ветряной оспе, поэтому требуется титр крови, чтобы доказать, что у вас «положительный» иммунитет. Справки от врача о том, что у вас ветрянка или опоясывающий лишай, недостаточно.
- Если ваши результаты титра не свидетельствуют об иммунитете, вам все равно необходимо будет получить любые оставшиеся дозы вакцины (вакцин), как указано выше.
- Примечание: при сообщении результатов титра помните, что «положительный» означает «положительный на иммунитет», а «отрицательный» означает «отрицательный на иммунитет».
Противостолбнячная, дифтерийная и коклюшная вакцина (Tdap)
Вы должны удовлетворить потребности в вакцине против столбняка, дифтерии и коклюша (Tdap):
- .
 Общие торговые марки в Соединенных Штатах включают Boostrix и Adacel.
Общие торговые марки в Соединенных Штатах включают Boostrix и Adacel. - Td, DPT, DTP и dTap НЕ выполняют это требование; если у вас есть только эти вакцины, вам все равно потребуется для получения вакцины Tdap.
- Каждые 10 лет рекомендуется ревакцинация Td. Для взрослых, которые никогда не получали Tdap, доза Tdap может заменить одну из 10-летних бустерных доз.
- Примечание: Столбнячный и дифтерийный анатоксины с бесклеточной коклюшной вакциной вводят подросткам и взрослым, как правило, в виде однократной дозы; Исключение составляют беременные женщины, которые должны получать Tdap в течение на каждую беременность.
Менингококковый конъюгат
Вы можете удовлетворить потребность в менингококковом конъюгате одним из следующих способов:
С помощью вакцины:
- Одна (1) доза в возрасте до 12 лет и старше для всех учащихся в возрасте 11 лет или старше и старше .

- Распространенные торговые марки включают Menactra (Men ACWY-D) и Menveo (Men ACWY-CRM) в США и Nimenrix (Men ACWY-CRM) в некоторых частях Западной Европы.
- Мужчины B и Bexsero НЕ выполнять это требование, равно как и вакцины против MCV4, полученные до достижения вами 16-летнего возраста; если у вас есть только эти вакцины, вам все равно потребуется для получения вакцины против MCV4.
- Хотя мы настоятельно предпочитаем вакцину MCV4, мы будем принимать вакцину MPSV4 при условии соблюдения требований к возрасту и документации.
- Примечание. В США доступны два типа менингококковых вакцин для серогрупп A, C, W и Y: полисахаридные и конъюгированные вакцины. Ни один из типов вакцин не содержит живых менингококковых бактерий.
В зависимости от возраста:
- Если вам еще нет 16 лет в первый день занятий, вы на данный момент освобождены от этого требования. Когда вам исполнится 16 лет, вам нужно будет выполнить это требование.

- Если вам уже исполнилось 22 года в первый день занятий, вы освобождаетесь от этого требования. Если вам исполнится 22 года после установленного срока, вы все равно должны получить эту вакцину.
Менингококковая инфекция B
Вы можете удовлетворить потребность в менингококковой инфекции B одним из следующих способов:
Вакциной: Вакцина B в возрасте от 16 до 23 лет. Есть два варианта вакцины: Bexsero и Trumenba. Bexsero представляет собой серию из двух доз, принимаемых с интервалом в один месяц. Trumenba представляет собой либо серию из двух доз с интервалом в шесть месяцев, либо серию из трех доз (одна доза в 0, 1-2 и 6 месяцев). Двухдозовая серия Trumenba обеспечивает адекватный охват, за исключением случаев, когда учащийся относится к группе высокого риска, находится в условиях высокого риска или имеет место вспышка.
Мы принимаем серию препаратов Trumenba с двумя дозами как удовлетворяющую нашим требованиям, но в случае вспышки менингококковой инфекции группы B для полной защиты потребуется третья доза Trumenba.
 По данным производителя, эффективность двухдозовой схемы Trumenba против различных штаммов N meningitidis группы B не подтверждена.
По данным производителя, эффективность двухдозовой схемы Trumenba против различных штаммов N meningitidis группы B не подтверждена. - Если вам еще не исполнилось 16 лет в первый день занятий, вы временно освобождены от этого требования. Когда вам исполнится 16 лет, вам нужно будет выполнить это требование.
- Если вам уже исполнилось 24 года в первый день занятий, вы освобождаетесь от этого требования. Если вам исполнится 24 года после официального крайнего срока, вы все равно должны получить эту вакцину.
- Три (3) дозы вакцины в течение как минимум 4-6-месячного периода (вторая доза вводится через месяц после первой дозы, третья доза вводится через шесть месяцев после первой дозы), согласно к Кодексу здоровья и безопасности штата Калифорния, гл.
 120390,5.
120390,5. - Титр – это анализ крови на антитела.
- Если результаты вашего титра не свидетельствуют об иммунитете, вы можете удовлетворить потребность в вакцинах, как указано выше
- Примечание: при сообщении результатов титра помните, что «положительный» означает «положительный на иммунитет», а «отрицательный» означает «отрицательный на иммунитет».
- Если вам уже 19 лет в первый день занятий, вы освобождаетесь от этого требования. Если вам исполнится 19 лет после установленного срока, вы все равно должны получить эту вакцину.
- Если вам больше 18 лет, вакцина против гепатита В по-прежнему рекомендуется.
В зависимости от возраста:
Гепатит B
Учащиеся в возрасте 18 лет или младше на момент начала своего первого семестра в кампусе CSU должны предоставить подтверждение иммунизации или положительный титр против гепатита B до начала второй четверти. Вы можете выполнить требование о наличии гепатита В одним из следующих способов:
Вакциной:
По титру:
В зависимости от возраста:
COVID-19
Зачисленные в настоящее время учащиеся должны зарегистрировать свой статус прививки от COVID-19 или заявить об освобождении от медицинской или религиозной принадлежности.
Все студенты, сотрудники и преподаватели должны соблюдать пересмотренную политику вакцинации против COVID-19 Калифорнийского государственного университета (CSU).
Определение Калифорнийского Политехнического университета «полностью вакцинированный» включает ревакцинацию для отвечающих критериям учащихся с 20 января 2022 г. Вы будете считаться полностью вакцинированными, если вы завершили серию первичных вакцин и получили ревакцинацию.
Если вы не имеете права на повторную прививку, вы по-прежнему будете считаться полностью вакцинированными до даты, когда вы получите право на повторную прививку. Затем вы должны получить бустерную дозу, чтобы оставаться полностью вакцинированным.
Получите дополнительную информацию о требованиях CSU к вакцинации против COVID-19.
4. Отправьте информацию и документы по иммунизации через Портал здравоохранения и консультирования (доступен после 1 мая). Однако все записи о прививках от COVID-19 должны быть представлены через Декларация о статусе вакцинации против COVID-19.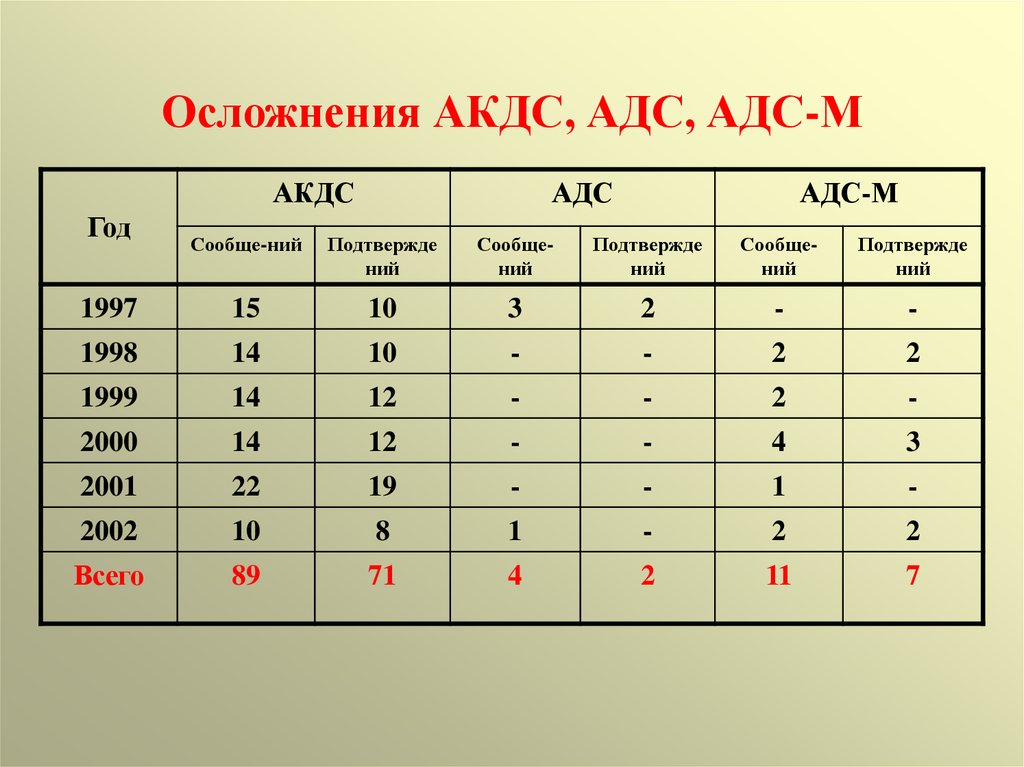

 walls{at}otago.ac.nz
walls{at}otago.ac.nz Обновленные рекомендации по использованию противостолбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной коклюшной вакцины (Tdap) у беременных женщин — Консультативный комитет по практике иммунизации (ACIP), 2012 г. MMWR Morb Mortal Wkly Rep 2013; 62:131–5.
Обновленные рекомендации по использованию противостолбнячного анатоксина, редуцированного дифтерийного анатоксина и бесклеточной коклюшной вакцины (Tdap) у беременных женщин — Консультативный комитет по практике иммунизации (ACIP), 2012 г. MMWR Morb Mortal Wkly Rep 2013; 62:131–5.  Безопасность и иммуногенность иммунизации против столбняка, дифтерии и бесклеточного коклюша (Tdap) во время беременности у матерей и младенцев: рандомизированное клиническое исследование. JAMA 2014; 311:1760–9. doi:10.1001/jama.2014.3633
Безопасность и иммуногенность иммунизации против столбняка, дифтерии и бесклеточного коклюша (Tdap) во время беременности у матерей и младенцев: рандомизированное клиническое исследование. JAMA 2014; 311:1760–9. doi:10.1001/jama.2014.3633  http://www.health.govt.nz/publication/new-zealand-maternity-clinical-indicators-2012 (по состоянию на 9 марта 2015 г.).
http://www.health.govt.nz/publication/new-zealand-maternity-clinical-indicators-2012 (по состоянию на 9 марта 2015 г.).  Эффективность материнской вакцинации против коклюша в Англии: обсервационное исследование. Ланцет 2014; 384:1521–8. doi:10.1016/S0140-6736(14)60686-3
Эффективность материнской вакцинации против коклюша в Англии: обсервационное исследование. Ланцет 2014; 384:1521–8. doi:10.1016/S0140-6736(14)60686-3  PG разработала инструмент для сбора данных, собрала и сопоставила большую часть данных. Она помогла с составлением рукописи и одобрила окончательный вариант. HP-H участвовала в разработке и дизайне концепции исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. LH участвовала в сборе данных и анализе данных, касающихся статуса иммунизации младенцев. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. NA участвовала в планировании и разработке исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант.
PG разработала инструмент для сбора данных, собрала и сопоставила большую часть данных. Она помогла с составлением рукописи и одобрила окончательный вариант. HP-H участвовала в разработке и дизайне концепции исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. LH участвовала в сборе данных и анализе данных, касающихся статуса иммунизации младенцев. Она помогла с составлением рукописи и одобрила окончательный вариант рукописи в представленном виде. NA участвовала в планировании и разработке исследования, а также в первоначальной заявке на финансирование. Она помогла с составлением рукописи и одобрила окончательный вариант.
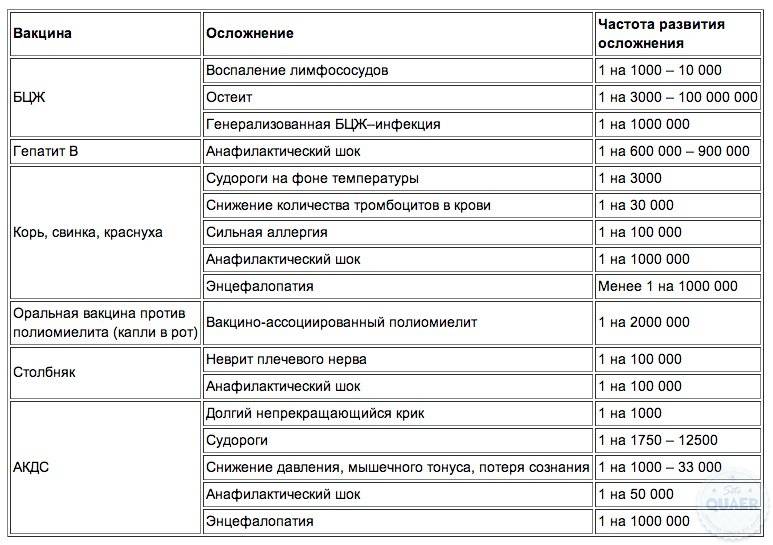 803.
803. 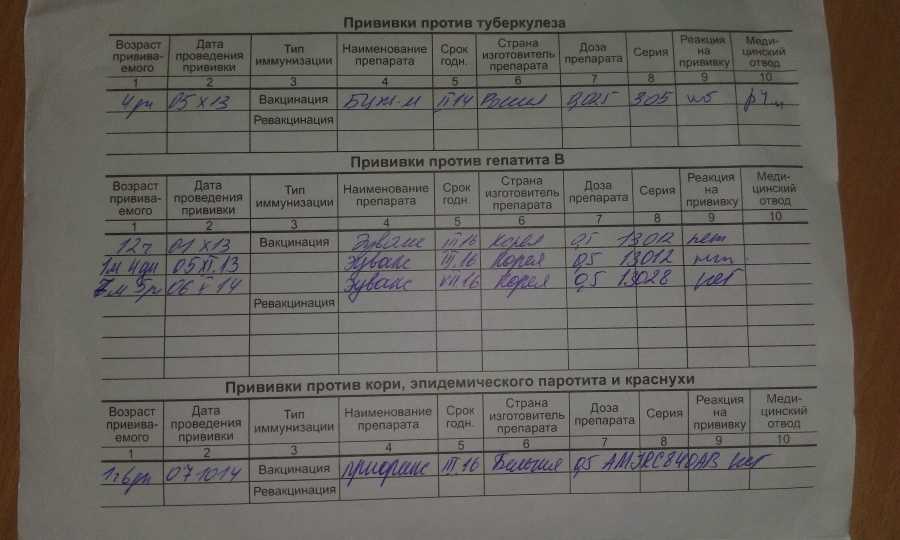



 Общие торговые марки в Соединенных Штатах включают Boostrix и Adacel.
Общие торговые марки в Соединенных Штатах включают Boostrix и Adacel.
.jpg) По данным производителя, эффективность двухдозовой схемы Trumenba против различных штаммов N meningitidis группы B не подтверждена.
По данным производителя, эффективность двухдозовой схемы Trumenba против различных штаммов N meningitidis группы B не подтверждена.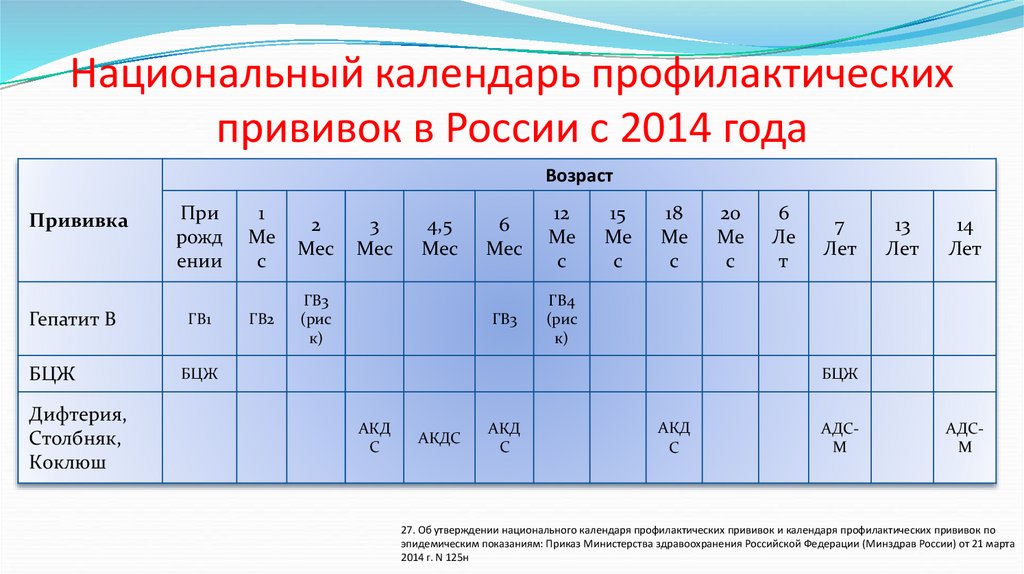 120390,5.
120390,5.