Содержание
Вакцинация | ЛДЦ №1 Липецк
Искать…
| ||||||
Записаться в 1 клик
Записаться в 1 клик
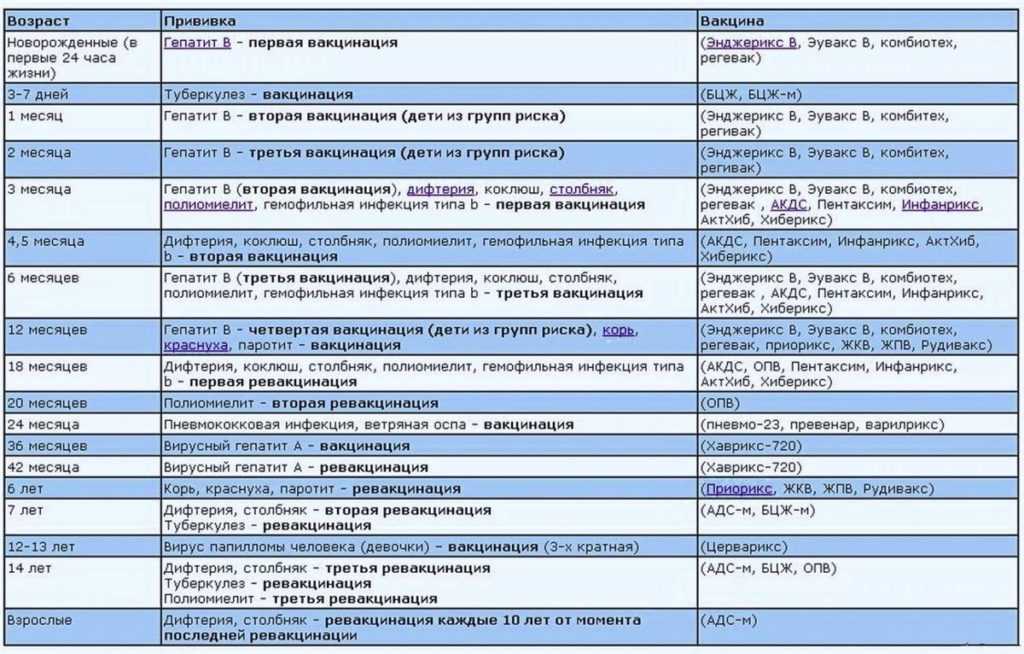
Иммунобиологические лекарственные препараты, реализуемые в настоящий момент ГАУЗ «ОАС»
Орск (3537) 407-407
Оренбург (3532) 507-507 (доб. ) 200
) 200
- Главная
- Пациентам
- ИЛП
| Иммунобиологические лекарственные препараты | Серии |
| АД-М-Анатоксин | П66 |
| П70 | |
| АДС-Анатоксин | У21 |
| У23 | |
| У26 | |
| АДС-М-Анатоксин | П14 |
| П32 | |
| П38 | |
| П39 | |
| П55 | |
| АС-Анатоксин | П83 |
| АКДС-вакцина | П53 |
| У50 | |
| У61 | |
| АКДС-Геп В | П7 |
| П9 | |
| П13 | |
| Аллерген бруцеллезный жидкий (Бруцеллин) | O1 |
| O2 | |
| Аллерген из пыльцы березы | С0214 |
| Аллерген из домашней пыли | 260317 |
| Аллерген туберкулезный | 10/92-0317 |
| 10/1-1017 | |
| 10/4-1017 | |
| 10/7-1117 | |
| Аллокин-альфа | 340717 |
| 431217 | |
| Альбумин | Н6290516 |
| Н751117 | |
| П60517 | |
| T241017 | |
| T1210091 | |
| T1210917 | |
| У55116 | |
| У591116 | |
| У990817 | |
| Альгавак М (Вакцина гепатита А) | 184 |
| 185 | |
| 188 | |
| 189 | |
| 194 | |
| 196 | |
| 204 | |
| 205 | |
| 206 | |
| 207 (220) | |
| 208 (221) | |
| 211 (219, 224) | |
| 212 (225) | |
| Антирабическая вакцина | 799 |
| 800 | |
| 824 | |
| 825 | |
| 833 | |
| 884 | |
| 886 | |
| 889 | |
| АС-анатоксин | П69 |
| П73 | |
| П74 | |
| П76 | |
| П79 | |
| У30 | |
| БиВак полио | 067 |
| 086 | |
| 088 | |
| 100 | |
| 101 | |
| 110 | |
| Бруцеллезная живая вакцина | О2 |
| Бубо-Кок | 095-1215 |
| 098-0416 | |
| БЦЖ | C147 |
| C155 | |
| 510 | |
| 512 | |
| 675 | |
| БЦЖ-М | 432 |
| 471 | |
| 500 | |
| C579 | |
| C591 | |
| C597 | |
| Варилрикс ® | 32020617 |
| Вианвак ® (вакцина брюшнотифозная) | 354-0616 |
| Витагерпавак | 030417 |
| Вода для инъекций (растворитель для приготовления лекарственных форм) | М520218 |
| Т1021116 | |
| Т2011017 | |
| Гардасил | N008093 |
| N023618 | |
| Гепатита В вакцина | 170-0215 |
| 178-0515 | |
| 180-0815 | |
| 189-0216 | |
| 197-0816 | |
| 204-0417 | |
| Гриппол ® плюс | 090717 |
| Диаскинтест ® | 050217 |
| 060217 | |
| 100317 | |
| 290717 | |
| 340917 | |
| 401117 | |
| Иммуноглобулин антирабический (из сыворотки крови человека) | 201612017R |
| 201712038R | |
| 201712039R | |
| Иммуноглобулин антирабический (из сыворотки крови лошади) | 160 |
| 161 | |
| 162 | |
| Иммуноглобулин человека против клещевого энцефалита | T14 |
| T39 | |
| T41 | |
| T52 | |
| T59 | |
| T65 | |
| 140417 | |
| 320917 | |
| Иммуноглобулин человека антирезус Rho (D) | 20116 |
| 30116 | |
| 40516 | |
| 60516 | |
| I21F40171A (ИММУНОРО КЕДРИОН) | |
| Иммуноглобулин человека нормальный | Н19 |
| Н47 | |
| П438 | |
| Т34 | |
| Т38 | |
177505 (И. Г.Вена) Г.Вена) | |
| Иммуноглобулин человека противоаллергический | У19 |
| У21 | |
| Иммуноглобулиновый комплексный препарат (КИП) | Н84 |
| h215 | |
| h218 | |
| 010118 | |
| Имурон-вак | 431 |
| 434 | |
| Инфанрикс® | 18160717 |
| 18170717 | |
| Инфанрикс® Гекса | 23101117 |
| 23111117 | |
| Инфлювак | N02R |
| Клещевого энцефалита вакцина («Клещ-Э-Вак») | 006 |
| 038 | |
| 039 | |
| 060 | |
| 072 | |
| 084 | |
| 099 | |
| 100 | |
| 116 | |
| 124 | |
| 146 | |
| 162 | |
| 907 | |
| 978 | |
| КОКАВ (вакцина) | У45 |
| У48 | |
| У50 | |
| У78 | |
| У80 | |
| У86 | |
| У91 | |
| КОКАВ (растворитель для вакцины) | У451116 |
| T020417 | |
| T030817 | |
| T040917 | |
| Коревая вакцина | M127 |
| M129 | |
| M186 | |
| M214 | |
| M232 | |
| M234 | |
| M263 | |
| M264 | |
349-01. 17 17 | |
| 352-05.17 | |
| 353-05.17 | |
| 354-05.17 | |
| 356-11.17 | |
| 358-11.17 | |
| 359-12.17 | |
| Краснухи вакцина | M596 |
| M597 | |
| M671 | |
| М672 | |
| М685 | |
| М732 | |
| М733 | |
| М734 | |
| Менактра | U5819AA |
| U5870AA | |
| U5914AG | |
| U6050AC | |
| Менингококовая вакцина группы А | Y20 |
| Менингококовая вакцина группы А+С | M11705 |
| M0278 | |
| Менцевакс® | A83CA369A |
| Паротитная вакцина | М0618 |
| М0620 | |
| М0623 | |
| М0633 | |
| Паротитно-коревая вакцина | М0047 |
| М0048 | |
| М00135 | |
| М00136 | |
| М00210 | |
| М00211 | |
| Пентаксим® | N1A05 + N1D10 |
| P0A481M (N1A88 | M1646) | |
| P0A471M (N1B39 | M1675) | |
| P0C641M (N3J20 | N1F15) | |
| P0D271M (N3M88 | N1H70) | |
| P0D251M (N3M88 | N1H89) | |
| P0E021M (P3B43 | N1F91) | |
| Пневмовакс® 23 | N015186 |
| N017819 | |
| Полимилекс вакцина для профилактики полиомиелита | A11145 |
| A11148 | |
| IPV923BA | |
| Превенар® 13 | 010216 |
| 020217 | |
| 060218 | |
| 070416 | |
| 090416 | |
| 100417 | |
| 110416 | |
| 160916 | |
| 181016 | |
| Приорикс® | 29101116 |
| Растворитель для коревой, паротитной, паротитно-коревой вакцин | 341-02.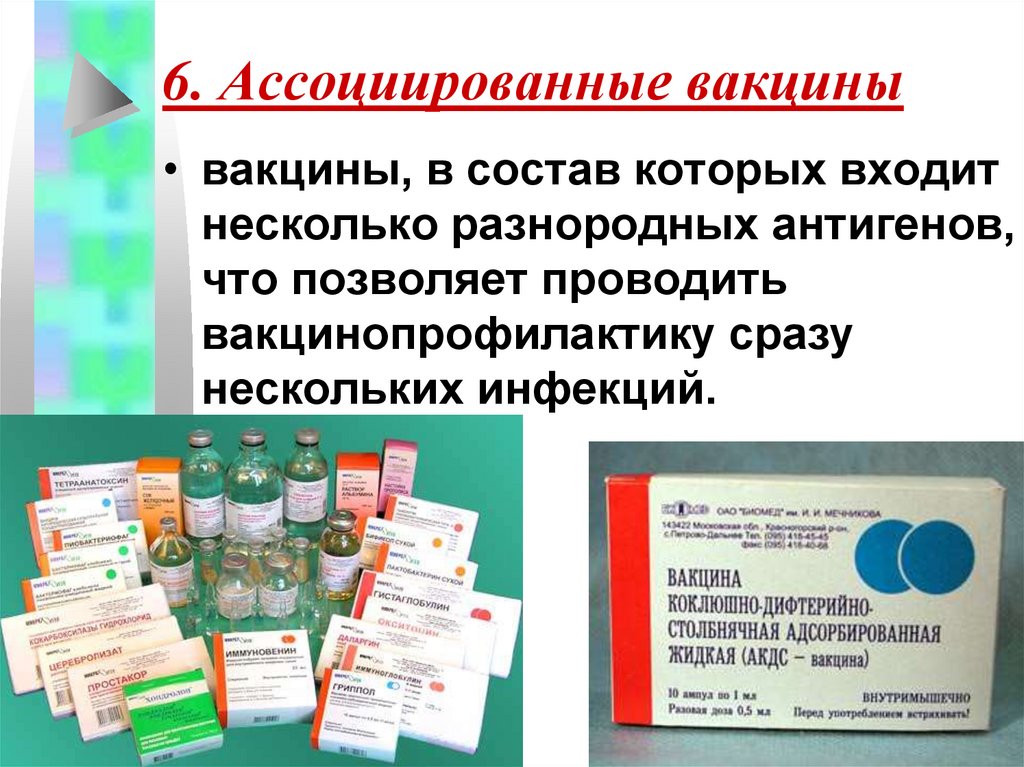 17 17 |
| 342-03.17 | |
| 345-06.17 | |
| 346-06.17 | |
| 347-06.17 | |
| 348-06.17 | |
| 349-06.17 | |
| 353-12.17 | |
| M1 | |
| M10 | |
| M12 | |
| M757 | |
| M758 | |
| M920 | |
| M937 | |
| M995 | |
| Ребинолин | RA5080717B |
| RA5171216A | |
| Регевак® В | 020316 |
| 060516 | |
| 070916 | |
| 111116 | |
| 170216 | |
| 180216 | |
| 431016 | |
| 521116 | |
| 541116 | |
| Сибиреязвенная вакцина | 265 |
| 2670117 | |
| 2690517 | |
| Сыворотка лошадиная очищенная | П1 |
| С22 | |
| С39 | |
| С41 | |
| С57 | |
| У7 | |
| У8 | |
| Сыворотка против яда гадюки | C40 |
| C45 | |
| C51 | |
| C52 | |
| Сыворотка противоботулиническая типа A | C92 |
| C96 | |
| C108 | |
| C1002 | |
| Сыворотка противоботулиническая типа B | C143 |
| C144 | |
| C1008 | |
| C1011 | |
| C1017 | |
| Сыворотка противоботулиническая типа E | C14 |
| Сыворотка противогангренозная поливалентная | П1 |
| П23 | |
| П26 | |
| П67 | |
| Сыворотка противодифтерийная | У3 |
| У4 | |
| У9 | |
| Сыворотка противостолбнячная лошадиная | C5 |
| C1072 | |
| C1089 | |
| C1093 | |
| Туляремийная вакцина | O3 |
| O14 | |
| O21 | |
| Тулярин (Аллерген туляремийный) | O1 |
| O3 | |
| O4 | |
| Хаврикс® | 60230117 |
| Церварикс® | 26020517 |
| Шигеллвак | 176-0417 |
| 186-1017 | |
| 194-0218 | |
| ЭнцеВир® | Т16 |
| Т17 | |
| Т21 | |
| Т25 | |
| Т27 | |
| Т29 |
О НАС
- Аптеки
- Аптеки 24
- Об учреждении
- Структура учреждения
- Контакты
- Новости
- Реквизиты
- Аптечное производство
- СОУТ
- Вакансии
- Программа лояльности
- Наши достижения
- Акции
- Блог директора
- Нормативные документы
- Политика конфиденциальности
- Поставщикам (IT)
- Обращение средств медицинского применения
ТОРГИ
- Сведения о закупках
- Положение о закупках
- Сервис 360
ПАЦИЕНТАМ
- Права пациентов
- Пациентские организации
- Пункты льготного отпуска
- Маркировка (МДЛП)
- Памятка НСУ
- Программа госгарантий
- Список ЖНВЛП
- Льготные лекарственные препараты
- ИЛП
- Осторожно, мошенники!
- Гирудотерапия
Мы в соц.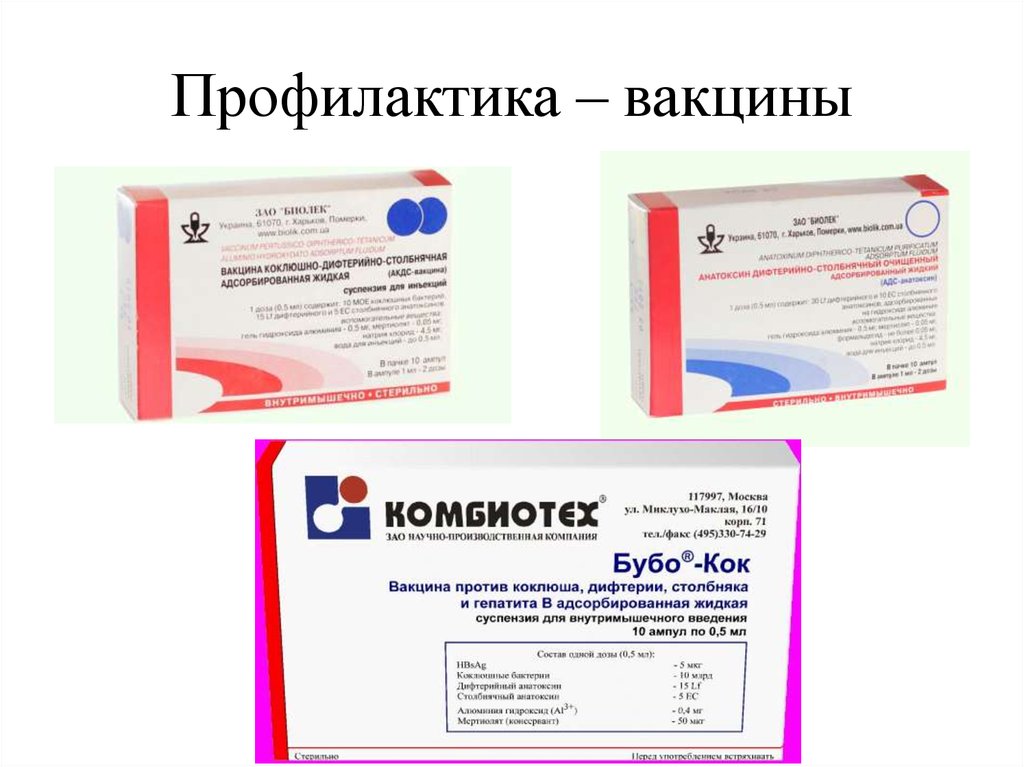 сетях
сетях
ГАУЗ «ОАС»
460044, г.Оренбург ул. Березка, 24
+7(3532)507-507 [email protected]
Лицензия на фарм. деятельность
Л042-01022-56/00270458 от 25.12.2020
ГАУЗ «ОАС» © 2020
Создание сайта Orenstudio
Согласие на обработку персональных данных
Настоящее согласие дано для отправки вопросов, отзывов и жалоб на официальном сайте государственного автономного учреждения здравоохранения
«Областной аптечный склад (www. gosapteka56.ru),
в целях обеспечения соблюдения Конституции РФ, Федеральных законов, Трудового кодекса РФ и иных нормативных правовых актов РФ, я подтверждаю осуществление любых действий Оператором (
Государственное автономное учреждение здравоохранения «Областной аптечный склад», юридический адрес: 460044, Оренбургская область, город Оренбург, ул. Березка, 24
) в отношении моих персональных данных, указанных в данном интернет-обращении, включая фамилию, имя, отчество, электронную почту,
номер телефона, которые необходимы или желаемы для достижения указанных выше целей, включая (без ограничения) сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение), использование, распространение
(в том числе передача), обезличивание, блокирование, уничтожение, а также осуществление любых иных действий с моими персональными данными в соответствии с федеральным законодательством как с использованием средств автоматизации, так и без такового.
В целях информационного обеспечения персональные данные, указанные в данном интернет-обращении, включая фамилию, имя, отчество, контактные данные сделать общедоступными, в том числе для публикации на официальном сайте ГАУЗ «ОАС».
Настоящее согласие вступает в силу со дня подписания и действует до достижения указанной цели обработки и последующего срока хранения документов, установленного законодательством РФ.
Согласие может быть отозвано по моему письменному заявлению путем направления соответствующего уведомления на электронный адрес: [email protected]
Анкета соискателя
e-mail *
Дата рождения *
Гражданство *
Адрес проживания *
Телефон *
Образование *
Желаемая должность *
Дополнительная информация (по желанию)
* Поля, обязательные для заполнения
*
Настояшим подтверждаю, что даю согласие на обработку своих персональных данных
в соответствии с ФЗ РФ от 27. 07.2006 №122-ФЗ «О персональных данных»
07.2006 №122-ФЗ «О персональных данных»
Исследования вакцинации против СПИДа с использованием ex vivo модели вируса иммунодефицита кошек: гомологичные эритроциты в качестве системы доставки для преимущественной иммунизации предполагаемыми защитными антигенами
. 1998 март; 5(2):235-41.
doi: 10.1128/CDLI.5.2.235-241.1998.
Л Кьярантини
1
, Д. Маттеуччи, М. Пистелло, У. Манчини, П. Маццетти, К. Масси, С. Джанеккини, И. Лонетти, М. Маньяни, М. Бендинелли
Принадлежности
принадлежность
- 1 Кафедра биомедицины, Пизанский университет, Италия.
PMID:
9521149
PMCID:
PMC121364
DOI:
10.
 1128/CDLI.5.2.235-241.1998
1128/CDLI.5.2.235-241.1998
Бесплатная статья ЧВК
Л. Кьярантини и др.
Клин Диагн Лаб Иммунол.
1998 март
Бесплатная статья ЧВК
. 1998 март; 5(2):235-41.
doi: 10.1128/CDLI.5.2.235-241.1998.
Авторы
Л Кьярантини
1
, Д. Маттеуччи, М. Пистелло, У. Манчини, П. Маццетти, К. Масси, С. Джанеккини, И. Лонетти, М. Маньяни, М. Бендинелли
принадлежность
- 1 Кафедра биомедицины, Пизанский университет, Италия.
PMID:
9521149
PMCID:
PMC121364
DOI:
10.
 1128/CDLI.5.2.235-241.1998
1128/CDLI.5.2.235-241.1998
Абстрактный
Вирус иммунодефицита кошек (FIV) является полезной моделью для проверки критериев разработки вакцины против СПИДа. В протоколе, который мы приняли, мы использовали первичный изолят FIV в качестве источника антигена и, для заражения, плазму от кошек, инфицированных гомологичным вирусом, никогда не пассированным in vitro. Эритроциты кошек (эритроциты) покрывали поверхностными компонентами свежесобранного и очищенного FIV с помощью биотин-авидин-биотиновых мостиков и использовали для иммунизации кошек, свободных от специфических патогенов (четыре дозы с интервалом в месяц; общее количество антигена FIV, вводимого на кошка, примерно 14 мкг). У иммунизированных кошек вырабатывались умеренные уровни антител, направленных в основном к поверхностным компонентам вириона, и четко выраженные лимфопролиферативные реакции. Через четыре месяца после введения последней дозы иммуногена кошек, иммунизированных FIV, и контрольных кошек, иммунизированных эритроцитами, покрытыми бычьим сывороточным альбумином, заражали. Судя по результатам последующего 12-месячного наблюдения, FIV-иммунизированные кошки показали, по крайней мере, некоторую степень защиты. Однако после повторного заражения большинство иммунизированных FIV животных стали вирусоположительными, несмотря на введение бустерной дозы иммуногена за 2 месяца до второго заражения.
Судя по результатам последующего 12-месячного наблюдения, FIV-иммунизированные кошки показали, по крайней мере, некоторую степень защиты. Однако после повторного заражения большинство иммунизированных FIV животных стали вирусоположительными, несмотря на введение бустерной дозы иммуногена за 2 месяца до второго заражения.
Цифры
РИС. 1
Валидация использованной процедуры…
РИС. 1
Валидация процедуры биотинилирования кошачьих эритроцитов. Исследовали биотин-положительные клетки…
ИНЖИР. 1
Валидация процедуры биотинилирования кошачьих эритроцитов. Биотин-положительные клетки зондировали FITC-стрептавидином и исследовали с помощью проточной цитометрии. M1., биотин-положительные клетки.
M1., биотин-положительные клетки.
РИС. 2
Характеристика биотинилированных белков…
РИС. 2
Характеристика белков, биотинилированных реакцией всего FIV с NHS-биотином. Указанный…
ИНЖИР. 2
Характеристика белков, биотинилированных реакцией всего FIV с NHS-биотином. Указанные вирусные препараты разрушали в SDS и подвергали SDS-10% PAGE. (A) Окрашивание кумасси синим и серебром геля, полученного с биотинилированным вирусом. (B) Авторадиография геля, полученного с биотинилированным FIV, который был 125 I с маркировкой после разрушения (пленка Kodak X-Omat AR при −70°C в присутствии усиливающих экранов Du Pont Lightning-Plus). (C) Окрашивание стрептавидином биотинилированного FIV. Гель наносили на нитроцеллюлозу, инкубировали со стрептавидином, конъюгированным с пероксидазой хрена, и исследовали с помощью ECL.
Гель наносили на нитроцеллюлозу, инкубировали со стрептавидином, конъюгированным с пероксидазой хрена, и исследовали с помощью ECL.
РИС. 3
Реакция антител ELISA на разрушенные…
РИС. 3
Реакция антител ELISA на разрушенный антиген FIV у кошек, иммунизированных FIV-RBC, и контрольных кошек. Твердый…
ИНЖИР. 3
Реакция антител ELISA на разрушенный антиген FIV у кошек, иммунизированных FIV-RBC, и контрольных кошек. Сплошные символы обозначают отдельных животных, иммунизированных FIV-RBC. Один открытый символ используется для кошек, иммунизированных BSA-RBC, поскольку все они не реагировали. Стрелки указывают время введения иммунизирующих доз, а сплошные стрелки указывают время заражения. (A) Ответ на первичную иммунизацию. (B) Ответ на бустерную дозу FIV-RBC, введенную через 20 месяцев после завершения первичной иммунизации.
(A) Ответ на первичную иммунизацию. (B) Ответ на бустерную дозу FIV-RBC, введенную через 20 месяцев после завершения первичной иммунизации.
РИС. 4
Иммуноблот-анализ сыворотки…
РИС. 4
Иммуноблот-анализ сывороток иммунизированных FIV-RBC и контрольных кошек во время…
ИНЖИР. 4
Иммуноблот-анализ сыворотки кошек, иммунизированных FIV-RBC, и контрольных кошек во время заражения. Очищенный FIV подвергали SDS-PAGE в восстанавливающих условиях, блотировали на нитроцеллюлозу и реагировали с сывороткой кошек, иммунизированных FIV-RBC (дорожки A-D), с сывороткой кошек, инфицированных FIV (дорожки E и F), с одним сыворотку от BSA-RBC-иммунизированной кошки (дорожка G) и сыворотку мыши, специфичную к SUgp (дорожка H) или контрольную (дорожка I).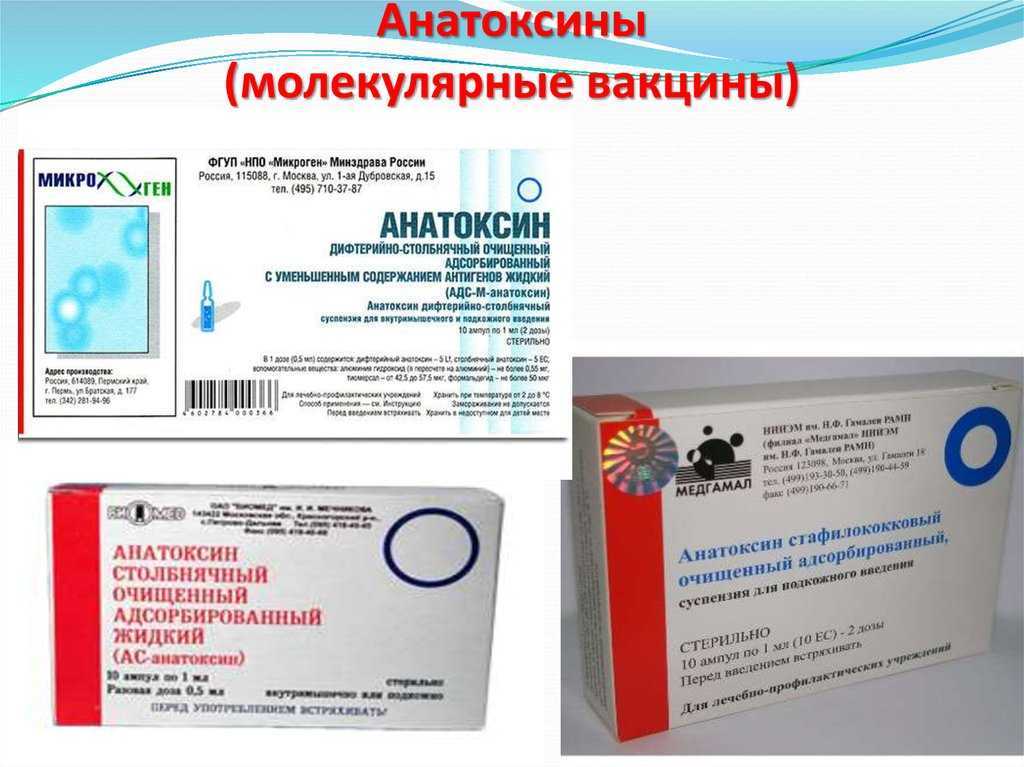 Дорожку L окрашивали на наличие гликопротеинов с помощью системы обнаружения гликопротеинов ECL в соответствии с инструкциями производителя.
Дорожку L окрашивали на наличие гликопротеинов с помощью системы обнаружения гликопротеинов ECL в соответствии с инструкциями производителя.
РИС. 5
Пролиферативный ответ на антиген FIV…
РИС. 5
Пролиферативный ответ на антиген FIV у отдельных кошек, иммунизированных FIV-RBC (сплошные столбцы)…
ИНЖИР. 5
Пролиферативный ответ на антиген FIV у отдельных кошек, иммунизированных FIV-RBC (заштрихованные столбцы) или BSA-RBC (незаштрихованные столбцы). (A) Ответ во время первого заражения (через 4 месяца после завершения первичной иммунизации). (B) Ответ во время второго заражения (через 2 месяца после бустерной дозы иммуногена). SI представляет собой отношение радиоактивности, инкорпорированной РВМС в присутствии антигена, к радиоактивности, инкорпорированной в отсутствие антигена. Только значения ≥2 считались показательными для FIV-специфической лимфопролиферации. В отсутствие антигена значения варьировались от 177 до 4488 имп/мин у отдельных кошек.
Только значения ≥2 считались показательными для FIV-специфической лимфопролиферации. В отсутствие антигена значения варьировались от 177 до 4488 имп/мин у отдельных кошек.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Исследования по вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек ex vivo: неспособность защитить и возможное усиление заражения при заражении четырьмя клеточными вакцинами, приготовленными с использованием аутологичных лимфобластов.
Джанеккини С., Изола П., Сичи О., Маттеуччи Д., Пистелло М., Заккаро Л., Дель Мауро Д., Бендинелли М.
Джанеккини С. и соавт.
Дж Вирол. 2002 июль; 76 (14): 6882-92. doi: 10.1128/jvi.76.14.6882-6892.2002.
Дж Вирол. 2002.PMID: 12072489
Бесплатная статья ЧВК.Оценка эффективности протокола первичной бустерной вакцинации: вакцина против вируса иммунодефицита кошек (FIV) на основе вируса оспы канареек и инактивированная клеточная вакцина, инфицированная FIV, против гетерологичного заражения FIV у кошек.

Телье М.С., Пу Р., Поллок Д., Вицкий А., Тарталья Дж., Паолетти Э., Ямамото Дж.К.
Телье М.С. и др.
СПИД. 1998 1 января; 12(1):11-8. doi: 10.1097/00002030-199801000-00002.
СПИД. 1998.PMID: 9456250
Вакцина ВИЧ-1 p24 защищает кошек от заражения вирусом кошачьего иммунодефицита.
Коулман Дж.К., Пу Р., Мартин М., Сато Э., Ямамото Дж.К.
Коулман Дж. К. и соавт.
СПИД. 2005 г., 23 сентября; 19(14):1457-66. doi: 10.1097/01.aids.0000183627.81922.be.
СПИД. 2005.PMID: 16135898
Инфекция слизистых оболочек и вакцинация против вируса иммунодефицита кошек.
Стоукс К.Р., Финерти С., Граффид-Джонс Т.Дж., Стерджесс К.П., Харбор Д.А.
Стокс Ч.Р. и соавт.
Дж Биотехнолог. 1999 20 августа; 73 (2-3): 213-21. doi: 10.1016/s0168-1656(99)00139-x.
doi: 10.1016/s0168-1656(99)00139-x.
Дж Биотехнолог. 1999.PMID: 10486930
Обзор.
Модель вируса иммунодефицита кошек для разработки вакцин против ВИЧ/СПИДа.
Ямамото Дж.К., Сану М.П., Эбботт Дж.Р., Коулман Дж.К.
Ямамото Дж.К. и др.
Curr HIV Res. 2010 Январь;8(1):14-25. дои: 10.2174/1570162107 361.
Curr HIV Res. 2010.
PMID: 20210778
Бесплатная статья ЧВК.
Обзор.
Посмотреть все похожие статьи
Цитируется
Эритроциты как носители: от доставки лекарств к биосенсорам.
Колева Л., Бовт Э., Атауллаханов Ф., Синауридзе Э.
Колева Л. и соавт.
Фармацевтика. 2020 18 марта; 12 (3): 276. doi: 10.3390/фармацевтика12030276.
Фармацевтика. 2020.
2020.PMID: 32197542
Бесплатная статья ЧВК.Обзор.
Обработка мембран эритроцитов для биомедицинских применений.
Росси Л., Фратернале А., Бьянки М., Маньяни М.
Росси Л. и др.
Фронт Физиол. 2019 авг 20;10:1070. дои: 10.3389/ффиз.2019.01070. Электронная коллекция 2019.
Фронт Физиол. 2019.PMID: 31481901
Бесплатная статья ЧВК.Обзор.
Клетки цельной крови, загруженные матричной РНК, в качестве противоопухолевой вакцины.
Фуа К.К., Бочковски Д., Даннулл Дж., Пруитт С., Леонг К.В., Наир С.К.
Фуа К.К. и др.
Adv Healthc Mater. 2014 июнь; 3 (6): 837-42. doi: 10.1002/adhm.201300512. Epub 2013 16 декабря.
Adv Healthc Mater. 2014.PMID: 24339387
Бесплатная статья ЧВК.Доставка лекарств красными кровяными тельцами: сосудистыми переносчиками, созданными матерью-природой.

Музыкантов В.Р.
Музыкантов ВР.
Экспертное заключение Препарат Делив. 2010 апр;7(4):403-27. дои: 10.1517/17425241003610633.
Экспертное заключение Препарат Делив. 2010.PMID: 20192900
Бесплатная статья ЧВК.Обзор.
Иммунизация пептидами протеазы ВИЧ, связанными с сингенными эритроцитами.
Боберг А., Доминичи С., Храбрый А., Халлермальм К., Хинкула Дж., Маньяни М., Варен Б.
Боберг А. и др.
Заразить Агент Рак. 2007 18 апр; 2:9. дои: 10.1186/1750-9378-2-9.
Заразить Агент Рак. 2007.PMID: 17442099
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
Исследования вакцинации против СПИДа с использованием вируса иммунодефицита кошек в качестве модели: иммунизация цельным инактивированным вирусом подавляет уровни виремии после интравагинального заражения инфицированными клетками, но не после внутривенного заражения бесклеточным вирусом
. 1999 20 августа; 18 (1-2): 119-30.
1999 20 августа; 18 (1-2): 119-30.
doi: 10.1016/s0264-410x(99)00189-9.
Д Маттеуччи
1
, M Pistello, P Mazzetti, S Giannecchini, P Isola, A Merico, L Zaccaro, A Rizzuti, M Bendinelli
принадлежность
- 1 Кафедра биомедицины, Пизанский университет, Италия.
PMID:
10501242
DOI:
10.1016/s0264-410x(99)00189-9
Д. Маттеуччи и др.
вакцина.
.
. 1999 20 августа; 18 (1-2): 119-30.
1999 20 августа; 18 (1-2): 119-30.
doi: 10.1016/s0264-410x(99)00189-9.
Авторы
Д Маттеуччи
1
, М. Пистелло, П. Маццетти, С. Джанеккини, П. Изола, А. Мерико, Л. Заккаро, А. Риццути, М. Бендинелли
принадлежность
- 1 Кафедра биомедицины, Пизанский университет, Италия.
PMID:
10501242
DOI:
10.1016/s0264-410x(99)00189-9
Абстрактный
Вирус иммунодефицита кошек (FIV) представляет собой прекрасную модельную систему для исследований вакцинации против СПИДа. В настоящих экспериментах мы исследовали иммуногенность и защитную активность двух инактивированных вакцин, приготовленных из первичного изолята вируса. Одна вакцина состояла из цельного вируса, инактивированного параформальдегидом и затем очищенного (WIV), а другая — из вирусных белков, экстрагированных эфиром твина (TEV). Обе вакцины вызывали сильный противовирусный ответ, но ни одна из них не давала заметного уровня устойчивости к системному заражению гомологичным вирусом. Кроме того, мы проверили, может ли вакцина против WIV, которая оказалась более иммуногенной, защитить от нетравматического интравагинального воздействия FIV-инфицированных клеток. Хотя пропорции контрольных и вакцинированных животных, которые заразились после заражения слизистой, были одинаковыми, вакцинированные имели значительно более низкую вирусную нагрузку, чем контрольные, что позволяет предположить, что иммунизация вакциной против WIV ограничивала репликацию FIV после интравагинального заражения.
В настоящих экспериментах мы исследовали иммуногенность и защитную активность двух инактивированных вакцин, приготовленных из первичного изолята вируса. Одна вакцина состояла из цельного вируса, инактивированного параформальдегидом и затем очищенного (WIV), а другая — из вирусных белков, экстрагированных эфиром твина (TEV). Обе вакцины вызывали сильный противовирусный ответ, но ни одна из них не давала заметного уровня устойчивости к системному заражению гомологичным вирусом. Кроме того, мы проверили, может ли вакцина против WIV, которая оказалась более иммуногенной, защитить от нетравматического интравагинального воздействия FIV-инфицированных клеток. Хотя пропорции контрольных и вакцинированных животных, которые заразились после заражения слизистой, были одинаковыми, вакцинированные имели значительно более низкую вирусную нагрузку, чем контрольные, что позволяет предположить, что иммунизация вакциной против WIV ограничивала репликацию FIV после интравагинального заражения.
Похожие статьи
Вакцинация Prime-boost с использованием ДНК и цельноинактивированных вирусных вакцин обеспечивает ограниченную защиту от вирулентного вируса иммунодефицита кошек.

Данхэм С.П., Брюс Дж., Кляйн Д., Флинн Дж.Н., Голдер М.С., Макдональд С., Джарретт О., Нил Дж.К.
Данэм С.П. и др.
вакцина. 2006 30 ноября; 24 (49-50): 7095-108. doi: 10.1016/j.vaccine.2006.07.001. Epub 2006 18 июля.
вакцина. 2006.PMID: 17049683
Оценка эффективности протокола первичной бустерной вакцинации: вакцина против вируса иммунодефицита кошек (FIV) на основе вируса оспы канареек и инактивированная клеточная вакцина, инфицированная FIV, против гетерологичного заражения FIV у кошек.
Телье М.С., Пу Р., Поллок Д., Вицкий А., Тарталья Дж., Паолетти Э., Ямамото Дж.К.
Телье М.С. и др.
СПИД. 1998 1 января; 12 (1): 11-8. doi: 10.1097/00002030-199801000-00002.
СПИД. 1998.PMID: 9456250
Исследования по вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек ex vivo: неспособность защитить и возможное усиление заражения при заражении четырьмя клеточными вакцинами, приготовленными с использованием аутологичных лимфобластов.

Джанеккини С., Изола П., Сичи О., Маттеуччи Д., Пистелло М., Заккаро Л., Дель Мауро Д., Бендинелли М.
Джанеккини С. и соавт.
Дж Вирол. 2002 июль; 76 (14): 6882-92. doi: 10.1128/jvi.76.14.6882-6892.2002.
Дж Вирол. 2002.PMID: 12072489
Бесплатная статья ЧВК.Эффективность и безопасность вакцины против вируса иммунодефицита кошек.
Хуанг С., Конли Д., Луп Дж., Чемп Д., Гилл М., Чу Х.Дж.
Хуан С и др.
Anim Health Res Rev. 2004 Dec;5(2):295-300. doi: 10.1079/ahr200487.
Anim Health Res Rev. 2004.PMID: 15984343
Обзор.
Исследования вакцин против SIV и FIV в Калифорнийском университете в Дэвисе: обновление 1991 года.
Гарднер М., Ямамото Дж., Мартас М., Миллер С., Дженнингс М.
 , Розенталь А., Люцив П., Планеллес В., Йилма Т., Джаведони Л. и др.
, Розенталь А., Люцив П., Планеллес В., Йилма Т., Джаведони Л. и др.
Гарднер М. и соавт.
AIDS Res Hum Retroviruses. 1992 авг; 8 (8): 1495-8. doi: 10.1089/aid.1992.8.1495.
AIDS Res Hum Retroviruses. 1992.PMID: 1334682
Обзор.
Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
Модель вируса иммунодефицита кошек для разработки вакцин против ВИЧ/СПИДа.
Ямамото Дж.К., Сану М.П., Эбботт Дж.Р., Коулман Дж.К.
Ямамото Дж.К. и др.
Curr HIV Res. 2010 Январь;8(1):14-25. дои: 10.2174/1570162107 361.Ориентация на лейкоциты троянского коня для профилактики ВИЧ.
Андерсон Д.
 Дж., Полич Дж.А., Надольски А.М., Бласкевич К.Д., Падни Дж., Майер К.Х.
Дж., Полич Дж.А., Надольски А.М., Бласкевич К.Д., Падни Дж., Майер К.Х.
Андерсон Д.Дж. и др.
СПИД. 2010 16 января; 24 (2): 163-87. doi: 10.1097/QAD.0b013e32833424c8.
СПИД. 2010.PMID: 20010071
Бесплатная статья ЧВК.Обзор.
Аннотация недоступна.
Новый метод получения клеток-мишеней и оценки активности цитотоксических Т-лимфоцитов у беспородных хозяев.
Бончи Ф., Забогли Э., Конти Ф., Мерико А., Фрир Г., Бендинелли М., Пистелло М.
Бончи Ф. и др.
БМС Биотехнология. 2009 11 марта; 9:18. дои: 10.1186/1472-6750-9-18.
БМС Биотехнология. 2009.PMID: 19284578
Бесплатная статья ЧВК.Оптимизированный дизайн самоинактивирующегося вектора вируса иммунодефицита кошек для трансдукции ex vivo дендритных клеток и Т-лимфоцитов.

Curr HIV Res. 2010.
PMID: 20210778
Бесплатная статья ЧВК.
Обзор.

 Суть этой процедуры заключается во введении в человеческий организм мертвых или ослабленных возбудителей болезней, их отдельных составляющих или продуктов жизнедеятельности (в отдельных случаях — созданных искусственно) для выработки организмом собственных антител к инфекции.
Суть этой процедуры заключается во введении в человеческий организм мертвых или ослабленных возбудителей болезней, их отдельных составляющих или продуктов жизнедеятельности (в отдельных случаях — созданных искусственно) для выработки организмом собственных антител к инфекции. Живые. В их основе лежат ослабленные штаммы возбудителей заболеваний.
Живые. В их основе лежат ослабленные штаммы возбудителей заболеваний.  Пример: вакцина от гепатита В (энджерикс).
Пример: вакцина от гепатита В (энджерикс). п.
п. 1128/CDLI.5.2.235-241.1998
1128/CDLI.5.2.235-241.1998 1128/CDLI.5.2.235-241.1998
1128/CDLI.5.2.235-241.1998
 doi: 10.1016/s0168-1656(99)00139-x.
doi: 10.1016/s0168-1656(99)00139-x. 2020.
2020.


 , Розенталь А., Люцив П., Планеллес В., Йилма Т., Джаведони Л. и др.
, Розенталь А., Люцив П., Планеллес В., Йилма Т., Джаведони Л. и др. Дж., Полич Дж.А., Надольски А.М., Бласкевич К.Д., Падни Дж., Майер К.Х.
Дж., Полич Дж.А., Надольски А.М., Бласкевич К.Д., Падни Дж., Майер К.Х.