Содержание
Что такое терапевтическая вакцина против ВИЧ?
Что такое терапевтическая вакцина против ВИЧ?
Последнее рассмотрение: 4 августа 2021 г.
Ключевые моменты
- Терапевтическая вакцина против ВИЧ — это вакцина, предназначенная для улучшения иммунного ответа организма на ВИЧ у человека, уже инфицированного ВИЧ.
- В настоящее время ни одна терапевтическая вакцина против ВИЧ не была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), но исследования продолжаются. Вы должны быть зачислены в клиническое испытание для получения терапевтической вакцины против ВИЧ.
- Исследователи изучают терапевтические вакцины против ВИЧ, чтобы замедлить прогрессирование ВИЧ-инфекции и устранить необходимость в антиретровирусной терапии (АРТ), сохраняя при этом неопределяемый уровень ВИЧ.
Что такое терапевтическая вакцина против ВИЧ?
Терапевтическая вакцина против ВИЧ — это вакцина, предназначенная для улучшения иммунного ответа организма на ВИЧ у человека, уже инфицированного ВИЧ.
Исследователи разрабатывают и испытывают терапевтические вакцины против ВИЧ, чтобы замедлить прогрессирование ВИЧ в синдром приобретенного иммунодефицита (СПИД). Есть надежда, что лечение людей этими вакцинами в идеале будет поддерживать ВИЧ на неопределяемом уровне (известном как неопределяемая вирусная нагрузка) без необходимости регулярной антиретровирусной терапии (АРТ). АРТ является рекомендуемым лечением ВИЧ-инфекции и включает использование комбинации различных лекарств от ВИЧ для предотвращения размножения ВИЧ. В настоящее время человек с ВИЧ должен продолжать получать АРТ, чтобы поддерживать уровень ВИЧ на неопределяемом уровне.
Терапевтическая вакцина против ВИЧ может также снизить вероятность передачи ВИЧ другим человеком.
Существуют ли одобренные FDA терапевтические вакцины против ВИЧ?
В настоящее время не существует утвержденных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) терапевтических вакцин против ВИЧ, но исследования продолжаются. Вы должны быть зачислены в клиническое испытание для получения терапевтической вакцины против ВИЧ.
Вы должны быть зачислены в клиническое испытание для получения терапевтической вакцины против ВИЧ.
Чем терапевтическая вакцина против ВИЧ отличается от профилактической вакцины против ВИЧ?
Профилактическая вакцина против ВИЧ вводится людям, у которых , а не ВИЧ, с целью предотвращения заражения ВИЧ в будущем. Вакцина учит иммунную систему человека распознавать ВИЧ и эффективно бороться с ним, если вирус когда-либо попадет в организм человека. Чтобы узнать больше, прочитайте HIVinfo Что такое профилактическая вакцина против ВИЧ? информационный бюллетень.
Терапевтическая вакцина против ВИЧ вводится людям, у которых уже ВИЧ. Целью терапевтической вакцины против ВИЧ является усиление иммунного ответа человека на ВИЧ, который уже находится в организме человека.
Где человек может получить больше информации о клинических испытаниях терапевтических вакцин против ВИЧ?
Список клинических испытаний терапевтических вакцин против ВИЧ доступен в базе данных резюме исследований ClinicalTrials. gov. Нажмите на название любого испытания в списке, чтобы просмотреть дополнительную информацию об исследовании.
gov. Нажмите на название любого испытания в списке, чтобы просмотреть дополнительную информацию об исследовании.
Если вы заинтересованы в участии в исследовании вакцины, вы также можете связаться с Центром исследования вакцин Национального института здравоохранения, позвонив по телефону 866-833-LIFE (5433) или отправив электронное письмо по адресу вакцины@nih.gov. Чтобы узнать больше, прочтите информационный бюллетень HIVinfo о клинических испытаниях ВИЧ и СПИДа.
Этот информационный бюллетень основан на информации из следующих источников:
Национальный институт аллергии и инфекционных заболеваний:
- Разработка вакцины против ВИЧ
- Устойчивая ремиссия ВИЧ без АРТ
Из Сети испытаний вакцины против ВИЧ:
- Как работают вакцины
См. также подборку ссылок и ресурсов по ВИЧ в разделе «Источник ВИЧ».
Революционная вакцина против ВИЧ, которая «тренирует» иммунную систему, преодолела первое препятствие
Совершенно новый вид вакцины, цель которой — вызвать ответ на ВИЧ «лучше, чем природа», завершил первое испытание иммуногенности на людях с многообещающими результатами .
Вакцина, получившая название eOD-GT8, разрабатывается профессором Уильямом Шифом и его коллегами из Исследовательского института Скриппса в Калифорнии в сотрудничестве с Онкологическим центром Фреда Хатчинсона, Международной инициативой по вакцине против СПИДа, Институтом аллергии и инфекционных заболеваний США. болезней и ряд других научно-исследовательских институтов. Фармацевтическая компания Moderna участвует в следующем этапе испытаний, поскольку будет использоваться та же технология мРНК-вакцины, которую фирма использовала в своей вакцине против SARS-CoV-2.
Целью вакцины является создание иммунных клеток (В-лимфоцитов), которые в случае контакта с ВИЧ наполняют организм антителами широкого нейтрализующего действия (bnAb) типа VRC01. Это конкретное bnAb обладает способностью нейтрализовать (блокировать) очень специфическую часть белка оболочки ВИЧ, которая необходима для проникновения вируса в клетки CD4.
Глоссарий
общие нейтрализующие антитела (bNAb)
Нейтрализующие антитела (NAb) — это антитела, которые полностью защищают клетку-мишень от антигена. Антитела широкого нейтрализующего действия (bNAb) представляют собой нейтрализующие антитела, обладающие таким действием в отношении широкого спектра антигенов. У людей, живущих с ВИЧ, был выделен ряд широко нейтрализующих антител. Некоторые из них изучаются и в некоторых случаях используются в клинических испытаниях для защиты людей от ВИЧ-инфекции, лечения ВИЧ-инфекции и уничтожения ВИЧ-инфицированных CD4+ Т-клеток в латентных резервуарах.
Антитела широкого нейтрализующего действия (bNAb) представляют собой нейтрализующие антитела, обладающие таким действием в отношении широкого спектра антигенов. У людей, живущих с ВИЧ, был выделен ряд широко нейтрализующих антител. Некоторые из них изучаются и в некоторых случаях используются в клинических испытаниях для защиты людей от ВИЧ-инфекции, лечения ВИЧ-инфекции и уничтожения ВИЧ-инфицированных CD4+ Т-клеток в латентных резервуарах.
белок
А
вещество, входящее в состав большинства клеток и ферментов.
иммунная система
Механизмы организма для борьбы с инфекциями и уничтожения дисфункциональных клеток.
оболочка
Внешняя поверхность вируса, также называемая оболочкой. Не все вирусы имеют оболочку. В случае ВИЧ оболочка содержит два вирусных белка (gp120 и gp41), которые первоначально продуцируются как один более крупный белок (gp160), который затем расщепляется на две части.
плацебо
Таблетка или жидкость, которая выглядит и на вкус точно такая же, как настоящее лекарство, но не содержит активного вещества.
Проблема в том, что bnAb до сих пор никогда не индуцировались вакциной у людей, а только хронической ВИЧ-инфекцией у меньшинства людей. Это связано с тем, что очень немногие В-лимфоциты обладают встроенной способностью когда-либо производить эти необычные «гипермутированные» bNAb с нуля.
В вакцине Скриппса используется метод, называемый «нацеливание на зародышевую линию», чтобы значительно расширить пул B-лимфоцитов, которые имеют необходимые гены, чтобы иметь возможность производить bNAb, и в текущем испытании G001 удалось это сделать — выдающийся подвиг это существенно перестраивает часть иммунной системы реципиента.
Вакцина eOD-GT8 была разработана для того, чтобы вызывать этот генетический ответ, а не фактически индуцировать bNAb, и не содержала всех компонентов белка оболочки ВИЧ, которые обычно вызывают гуморальный ответ. Ожидается, что в будущих испытаниях потенциальная возможность производства bNAb VRC01 станет реальностью за счет использования вакцин, еще более тесно связанных с подразделами белка оболочки ВИЧ, которые вызывают самые сильные ответы bNAb. Они называются эпитопами.
Они называются эпитопами.
Узнайте больше на наших страницах о ВИЧ
Результаты исследования G001, первого в своем роде, опубликованы в журнале Science. В ходе исследования более высокая из двух доз вакцины индуцировала производство в 550 раз большего количества клеток, способных продуцировать bnAb VRC01, чем это происходит в природе, а у ответивших процент B-клеток в лимфатических узлах, которые имели генетические мутации (называемых VRC01-2*02 или VRC01-2*04), способных производить bNAb, увеличилось до 6,7% по сравнению со средним показателем 0,00023% (всего одна клетка на 429 000) у непривитых людей.
Аффинность молекул рецепторов, продуцируемых на поверхности этих клеток, – их чувствительность к эпитопам ВИЧ или к антителам к этим эпитопам – увеличилась в 840 раз по сравнению с клетками, не имевшими мутаций VRC01-2.
Подробнее об истории болезни
Подробнее о том, почему ВИЧ является таким трудным вирусом для разработки вакцины против ВИЧ, см. здесь, но, возможно, основной причиной является способность ВИЧ быстро мутировать, выходя из-под иммунного контроля. В подавляющем большинстве случаев заражения вирус уже выиграл гонку против иммунной системы, прежде чем последняя едва успела сойти со старта.
здесь, но, возможно, основной причиной является способность ВИЧ быстро мутировать, выходя из-под иммунного контроля. В подавляющем большинстве случаев заражения вирус уже выиграл гонку против иммунной системы, прежде чем последняя едва успела сойти со старта.
У некоторых людей в конечном итоге вырабатываются широко нейтрализующие антитела, но делают это слишком поздно, когда вирус уже развил способность перехитрить их. Но если бы мы могли внедрить эту способность в достаточное количество В-лимфоцитов для производства bnAb против ВИЧ в тот момент, когда они его увидели, тогда иммунная система выиграла бы гонку.
Подход, используемый командой Шифа, не единственный, который пытается это сделать. В подходе, называемом дизайном, ориентированным на эпитопы, исследователи пытаются разработать поливалентную вакцину, которая распознает как можно больше эпитопов ВИЧ и продуцирует bNAb против них.
Дизайн, ориентированный на родословную, реконструирует это. Ученые изучают bNAb у людей, у которых они развиваются при хронической инфекции, выясняют, на какие эпитопы ВИЧ они развились в ответ, а затем разрабатывают вакцины, стимулирующие вакцины к этим эпитопам.
Проблема с обоими этими подходами заключается в том, что существует так мало В-лимфоцитов, которые имеют гены для производства bNAb, что эффективные количества не генерируются.
То, что делает нацеливание на зародышевую линию, заключается в том, чтобы вернуться к обратному инжинирингу еще на один этап и задаться вопросом: можем ли мы разработать эволюционный иммунный процесс, который начинается с наивных B-лимфоцитов, которые не специфически распознают какую-либо ошибку, и заканчивается памятью B- клетки, которые могут производить потоки различных bnAb в ответ на ВИЧ?
VRC01 был одним из первых широко нейтрализующих антител, обнаруженных в крови человека с длительной ВИЧ-инфекцией. Его структура и активность были определены в 2010 году. В исследованиях с использованием инфузий антитела для лечения ВИЧ или для предотвращения ВИЧ-инфекции оно обладало некоторой эффективностью, но само по себе было недостаточным для подавления репликации ВИЧ, а его эффективность в профилактике ВИЧ была лишь скромной..jpg) Однако иммунная система, настроенная на выработку большого количества VRC01, как только она обнаруживает ВИЧ, может работать лучше.
Однако иммунная система, настроенная на выработку большого количества VRC01, как только она обнаруживает ВИЧ, может работать лучше.
Причина, по которой исследователи Скриппса выбрали VRC01 в качестве bNAb, который они хотели создать, заключается не в том, что он уже использовался, а в том, что клетки, способные его производить, имеют уникальную генетическую подпись. Все антитела представляют собой Y-образные молекулы. Гены, необходимые для производства определенного ряда аминокислот (белковых компонентов), которые становятся антителом VRC01, представляют собой либо один, либо оба гена VRC01-2*02 или *04, которые производят «тяжелую цепь» антитела ( одно плечо и стебель Y) и любые пять, но не любое другое количество, аминокислот, которые производят «легкую цепь», другое плечо Y.
Только одна В-клетка из более чем 400 000 естественно имеет эту генетическую конформацию, и белки оболочки ВИЧ, встречающиеся при инфицировании, по-видимому, не стимулируют эти «предшественники» В-клеток ни к специфической пролиферации, ни к образованию bNAb.
На основе данных предыдущих клинических испытаний на мышах команда Шифа разработала вакцину, которая предпочтительно вызывала бы деление и размножение клеток с такой генетической конформацией. Он не был разработан и не производил сам VRC01 bNAb, а производил больше клеток, из которых он состоит.
Это значительно усложнило проведение исследования: относительно просто измерить количество антител в крови, но намного сложнее изучить гены в клетках, которые их производят, и исследователям пришлось для этого используйте несколько способов, в том числе сортировку клеток с помощью проточной цитометрии и использование ПЦР-анализов РНК и ДНК.
Вакцина и участники исследования
Вакцина eOD-GT8 представляет собой вирусоподобную частицу – полую оболочку нечеловеческого белка. Вакцины на основе вирусоподобных частиц не новы — вакцина против ВПЧ, которая предотвращает остроконечные кондиломы, рак шейки матки и анальный рак, является одной из них. В данном случае нечеловеческим белком является люмазинсинтаза, фермент, обнаруженный в организмах, которые могут вырабатывать собственный рибофлавин (витамин B2). Шестьдесят молекул фермента спонтанно собираются в полую оболочку в рамках его функции синтеза. К этому исследователи присоединили 60 молекул белка оболочки ВИЧ, по одной на единицу фермента, настроенных на то, чтобы вызвать пролиферацию в клетках с генетическим профилем VRC01.
Шестьдесят молекул фермента спонтанно собираются в полую оболочку в рамках его функции синтеза. К этому исследователи присоединили 60 молекул белка оболочки ВИЧ, по одной на единицу фермента, настроенных на то, чтобы вызвать пролиферацию в клетках с генетическим профилем VRC01.
Эта вакцина или плацебо была введена 48 добровольцам двумя дозами с интервалом в восемь недель; 12 получили плацебо, 18 получили дозу вакцины 20 мкг и 18 — дозу 100 мкг. К обеим дозам вакцины добавляли 50 мкг адъюванта, соединения, усиливающего иммунный ответ на вакцину. В данном случае адъювантом был ASO1 B , смесь двух встречающихся в природе соединений, которые помогают вакцине прикрепляться к рецепторам В-лимфоцитов (поверхностным белкам, воспринимающим чужеродные вещества).
Добровольцы были довольно сбалансированы с точки зрения пола (18 женщин, 24 мужчин) и пола при рождении (четверо мужчин были трансгендерами, среди женщин не было ни одной, но двое добровольцев назвали себя гендерквирами или нонконформистами).
Это исследование, проведенное в США, не было столь сбалансированным с точки зрения расы; 33 (69%) были классифицированы как белые, из которых шесть были латиноамериканцами; четверо были чернокожими, пять азиатами, трое представителей смешанной расы и один неизвестный. Их средний возраст составлял 30 лет.
Вакцина имела некоторые побочные эффекты: больше людей, получавших вакцину, чем люди, получавшие плацебо, жаловались на боль в месте инъекции, легкую головную боль, озноб, боль в суставах, умеренную лихорадку и недомогание или утомляемость. Однако частота тяжелых симптомов (степень 3) была не выше, чем у реципиентов плацебо.
Эффекты вакцины
Вакцина действительно вызывала общую реакцию в непродуцирующих bNAb наивных В-клетках и Т-клетках, показывая, что она действительно обладает общей иммуногенностью (о чем также свидетельствуют побочные эффекты). В-клетки, циркулирующие в крови, увеличились примерно в тысячу раз. В-клетки в лимфатических узлах, куда они попадают для многократного воздействия чужеродных антигенов и превращения в клетки памяти, распознающие специфические антигены, перед тем, как вернуться в кровоток, увеличиваются в 100 000 раз и более.
Но никаких специфических реакций на ВИЧ у них не выработалось. Этого и следовало ожидать, поскольку эта прививочная вакцина не была разработана для непосредственного ответа на ВИЧ и не содержала поверхностных белков ВИЧ, которые, как известно, являются прямыми иммуногенными в этом отношении.
Сильная генерализованная иммунная реакция на белки env ВИЧ на самом деле была бы контрпродуктивной, поскольку она заставила бы В-клетки вырабатывать ненейтрализующие антитела против ВИЧ, которые не работают. Суть заключалась в том, чтобы увеличить популяцию клеток-предшественников, генетическая сигнатура которых показывала, что если использовать более позднюю вакцину, содержащую специфический иммуногенный эпитоп ВИЧ, полезная часть продуцируемых антител будет составлять bnAb.
Основная цель вакцины — увеличить популяцию В-клеток, способных производить bnAb, — была достигнута. Не вдаваясь в подробности, исследователи рассмотрели три популяции В-лимфоцитов и подсчитали долю, которая имела генетический профиль VRC01. Два из них, те, что циркулируют в крови, и те, что созревают в лимфатических узлах, образуют наиболее распространенный тип антител, иммуноглобулин G (IgG), который составляет 75% циркулирующих антител. Они также измерили количество клеток в крови, вырабатывающих редкий тип антител, иммуноглобулин D, который формирует только 1% антител, но, по-видимому, играет роль, направляя выработку антител другими В-клетками.
Два из них, те, что циркулируют в крови, и те, что созревают в лимфатических узлах, образуют наиболее распространенный тип антител, иммуноглобулин G (IgG), который составляет 75% циркулирующих антител. Они также измерили количество клеток в крови, вырабатывающих редкий тип антител, иммуноглобулин D, который формирует только 1% антител, но, по-видимому, играет роль, направляя выработку антител другими В-клетками.
В образцах до вакцинации исследователи обнаружили шесть участников, у которых можно было идентифицировать клетки-предшественники с профилем VCR01, но буквально только в одной или двух отдельных клетках, что указывает на то, что даже у этих участников только одна из 429 000 В-клеток имела этот подпись. После вакцинации они также обнаружили эту сигнатуру у двух получателей плацебо.
Среди вакцинированных участников клетки VRC01 пролиферировали у всех, кроме одного участника. У этого участника оказалась необычная генетическая сигнатура VRC01, VCR01-2*05/*06, что свидетельствует о том, что примерно 2% (преимущественно белых участников из США) могут не реагировать на эту вакцину.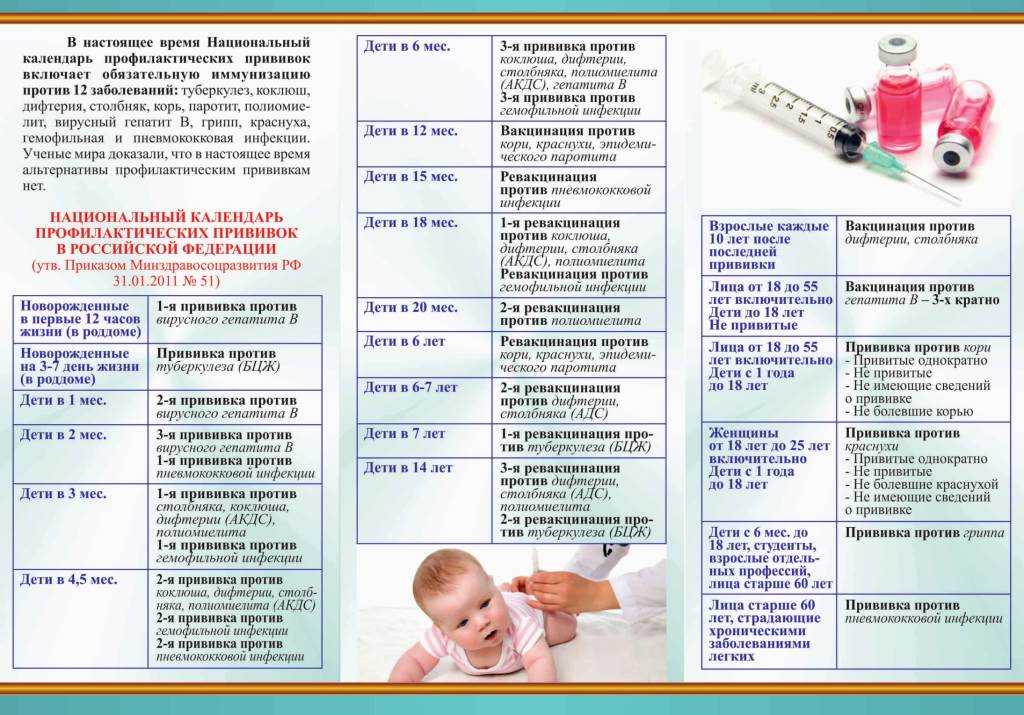 Будут ли люди из других частей мира иметь разные генетические профили, вопрос, на который еще предстоит ответить.
Будут ли люди из других частей мира иметь разные генетические профили, вопрос, на который еще предстоит ответить.
Через четыре недели после первой вакцинации один из 10 000 клеток циркулирующей крови у реципиентов с более низкими дозами и один из 4500 у реципиентов с более высокими дозами обладал способностью продуцировать VRC01, что, соответственно, в 43 и 94 раза превышает частоту до вакцинации.
К 10-й неделе, через две недели после второй вакцинации, одна из 1139 клеток В-памяти у реципиентов с низкими дозами и одна из 777 у реципиентов с высокими дозами были типа предшественника VRC01, что в 377 и 552 раза больше, чем до вакцинации частота. К восьми неделям после второй дозы это число снизилось до одного в 3764 и одного в 2019 году.ячейки соответственно.
Важно подчеркнуть, что даже на пике, хотя у всех участников, кроме одного, теперь были В-клетки с рецепторами, которые указывали на то, что они могут продуцировать bnAb при столкновении с эпитопами ВИЧ, это по-прежнему составляло лишь 0,088% всех В-клеток памяти.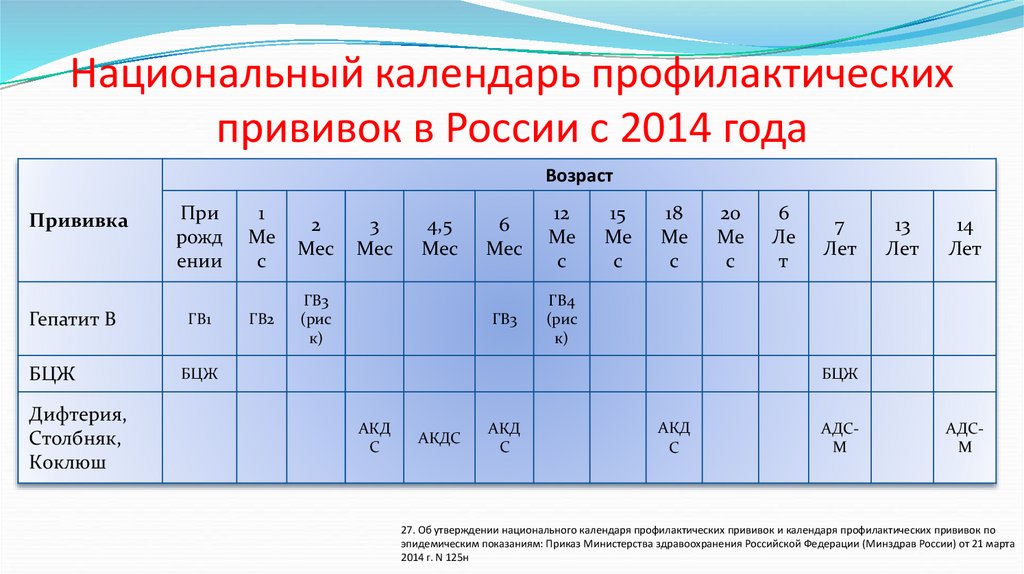 Исследователи надеются, что теперь, когда эти клетки-предшественники были выявлены, дальнейшие иммунизации вакцинами, которые действительно содержат эпитопы ВИЧ (в отличие от этой), теперь будут производить эффективное количество bNAb VRC01.
Исследователи надеются, что теперь, когда эти клетки-предшественники были выявлены, дальнейшие иммунизации вакцинами, которые действительно содержат эпитопы ВИЧ (в отличие от этой), теперь будут производить эффективное количество bNAb VRC01.
Что касается В-клеток, созревающих в лимфатических узлах, только около 60% участников имели увеличение числа В-клеток типа VRC01, созревающих в их лимфатических узлах. Однако среди тех, которые это сделали, количество клеток с сигнатурой гена VRC01 было примерно в 100 000 раз больше, чем раньше, при этом до 6,7% всех В-клеток, продуцирующих IgG, имели сигнатуру гена VRC01.
Обнадеживающим признаком было то, что в популяции клеток с генами VRC01 наблюдались широкие вариации остальных генов, которые инструктируют клетку, какие антитела вырабатывать. Эта «поликлональность» указывает на то, что они должны быть в состоянии реагировать на широкий спектр вариантов ВИЧ.
Секвенирование чувствительного гена также показало, что, хотя абсолютное количество клеток VRC01 уже снижалось в течение восьми недель после введения второй вакцины, количество мутаций в клетках с сигнатурой VRC01 продолжало накапливаться, что указывает на повышенный потенциал для создания различных BnAb типа VRC01.
Эти мутации также придают повышенную чувствительность клеток, продуцирующих bnAb VRC01, к типичным эпитопам белка env ВИЧ, что указывает на увеличение не только количества клеток bnAb, которые могут продуцироваться в ответ на воздействие ВИЧ, но и их чувствительности. Через три недели после введения первой вакцины аффинность В-клеточных рецепторов к эпитопам оболочки ВИЧ в клетках типа VCR01 была в 840 раз выше (т. е. в 840 раз меньше белка env будет вызывать реакцию, чем тот, который вызовет реакцию в клетках, отличных от VRC01), и через три недели после второго — в 32 400 раз выше.
Это важно, потому что предполагает, что, хотя изначально В-клетки, продуцирующие VRC01, могут быть меньшинством, их продукция bNAb не будет уступать большинству клеток, которые продуцируют неэффективные, ненейтрализующие антитела, которые ВИЧ может легко мутировать.
Можно ли превратить это в настоящую вакцину?
В комментарии к исследовательскому документу профессор Пенни Мур из Южноафриканского национального института инфекционных заболеваний, известный исследователь вакцины против ВИЧ, называет это первым доказательством очень сложной концепции.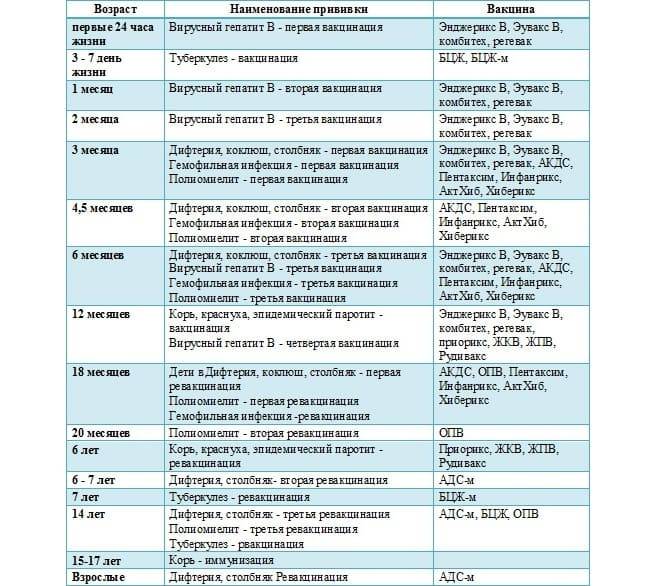
Она отмечает, что исследование необходимо повторить с участием участников из других регионов и этнических групп, а также что необходимо проводить исследования с вакцинами, которые расширяют клеточные популяции, способные продуцировать другие bnAb с большей эффективностью, чем VRC01, и которые нацелены на части Белок оболочки ВИЧ, отличный от сайта связывания CD4. Это может быть сложнее, поскольку другие bnAb происходят из клеток с менее специфическими генетическими сигнатурами.
Основная проблема, однако, заключается в том, что это только первый шаг в этой концепции вакцины. Следующим шагом будет последовательная прививка людям серией вакцин, содержащих эпитопы, основанные на еще более близких белках env вируса ВИЧ.
Трудно сказать, как это можно сделать. Вакцина, содержащая многочисленные эпитопы ВИЧ, может иметь большой объем, а также сопряжена с риском того, что она может перегрузить иммунную систему и вызвать массивную, но неспецифическую реакцию, которая может быть не только небезопасной, но и не работать против ВИЧ. Альтернативой является предоставление людям длинной последовательности вакцин с целью «направить» иммунную систему на выработку bnAb, но это будет сложно с логистической и клинической точек зрения.
Альтернативой является предоставление людям длинной последовательности вакцин с целью «направить» иммунную систему на выработку bnAb, но это будет сложно с логистической и клинической точек зрения.
Один из возможных ответов заключается в том, что вакцины для зародышевой линии на следующей стадии, в испытаниях G002 и т. д., будут использовать вакцины на основе мРНК, а не вирусоподобные частицы. Они заставят клетки создавать свои собственные частицы, а не вводить их, а затем направлять. Это означает, что ряд различных инструкций можно было бы упаковать в меньшую дозу вакцины, а также то, что изготовление различных прививок вакцины должно быть проще. Испытание G003 проходит в Руанде и Южной Африке, что может ответить на вопрос, работает ли вакцина, предназначенная для выявления VRC01, также и в африканском населении.
По сути, исследователи Скриппса создали значительную популяцию клеток, по крайней мере, потенциально способных производить один конкретный тип bnAb, который раньше был незначительным.
