|
|
||||||||||
|
1. Антибиотики. История открытия. Классификация антибиотиков по способам получения, по происхождению, химическому строению, механизму действия, спектру антимикробного действия. Механизм действия антибиотиков на микробную клеткуМеханизм действия антибиотиков на микробную клетку.Количество просмотров публикации Механизм действия антибиотиков на микробную клетку. - 171 АНТИБИОТИКИ В ХИРУРГИИ Лекция 16 Успех хирургии последних лет стал возможен благодаря развитию науки и техники, анестезиологии и совершенствованию техники хирургических операций. В то же время большое значение для него имело внедрение в широкую клиническую практику антибиотикотерапии. Начав свое триумфальное шествие в области лечения инфекционных заболеваний, антибиотики в короткое время приобрели необычайную популярность среди врачей всех специальностей, а тем более хирургов. При этом уже через 10-15 лет после начала широкого применения антибиотиков стало ясно, что они не оправдали возлагавшихся на них надежд. В литературе стали появляться работы, в которых сообщалось о росте числа штаммов антибиотикоустойчивых гноеродных бактерий и о появлении антибиотикозависимых форм бактерий, а также о том, что в результате беспорядочного применения антибиотиков обнаружились побочные действия этих препаратов, приводящие в отдельных случаях к гибели больного. В данной лекции хотелось бы остановиться на вопросах о механизме действия антибиотиков, как на микробную клетку, так и на организм больного; о побочных действиях антибиотиков, возникающих при неправильном использовании антибиотикотерапии, а также дать представление о правилах, которые крайне важно выполнять для того, чтобы антибиотикотерапия стала надежным помощником в лечении хирургических заболеваний. В 1945 году Woksman указывал на ряд возможных механизмов действия антибиотиков на микроорганизмы. Он считал, что антибиотики нарушают процесс пролиферации микробных клеток, а также обмен веществ в них. Под действием антибиотиков повреждаются некоторые ферментные системы, и нарушается механизм дыхания микробных клеток. Антибиотики подавляют окислительные процессы в микробной клетке и т.д. Сегодня установлено, что по механизму действия на микробную клетку антибиотики делят на две группы: 1 – антибиотики, нарушающие функцию стенки микробной клетки; 2 – антибиотики, влияющие на синтез РНК и ДНК или белков в микробной клетке. Антибиотики первой группы в основном воздействуют на биохимические реакции стенки микробной клетки. Антибиотики второй группы влияют на обменные процессы в самой микробной клетке. При изучении механизма действия различных антибиотиков на микробную клетку было установлено, что хотя в базе его лежит нарушение синтеза белка в микробной клетке, тем не менее, проявления его разнообразны. Так, пенициллин не повреждает цитоплазму клетки, но блокирует биосинтез мукопептида оболочкой клетки. Τᴀᴋᴎᴍ ᴏϬᴩᴀᴈᴏᴍ, чувствительность к пенициллину обуславливается чувствительностью к нему аппарата͵ обеспечивающего размножение клеток. Микробные клетки, находящиеся в покое, к пенициллину не чувствительны. Эритромицин относится к бактериостатическим препаратам и аналогично тому, как и стрептомицин, подавляет синтез белка. Стрептомицин действует как на размножающие клетки, так и на клетки, находящиеся в состоянии покоя, подавляя их дыхательный процесс. Г.И.Харченко (1963) показал, что в транспортировке антибиотиков к органам и тканям организма важную роль играют белки, которые он разделил на два типа: 1- альбуминовый, который транспортирует кристалломицин, пенициллин, стрептомицин, мицерин, эритромицин; и 2 – глобулиновый, транспортирующий хлортетрациклин, альбомицин. По этой причине изменение в организме больного количества альбумина и глобулина следует учитывать в выборе антибиотика для лечения патологического процесса. В последние годы возникла одна из наиболее серьезных проблем антибиотикотерапии – проблема адаптации патогенных возбудителей к антибиотикам. По мнению З.В.Ермольевой (1966) развитие устойчивости микробов к антибиотикам обусловлено теми же общебиологическим законами, что и образование самих антибиотиков – сопротивляясь вредным воздействиям, микробные клетки вырабатывают новые защитные механизмы. Особенно часто приобретение устойчивости происходит тогда, когда микроорганизмы длительно подвергаются действию низких концентраций антибиотиков. Резистентные штаммы возникают в результате селекции, адаптации и мутации. Немаловажную роль в ускорении формирования этих штаммов играет концентрация антибиотиков. Работами отечественных и зарубежных авторов доказано, что устойчивые к антибиотикам микроорганизмы выделяют в окружающую среду трансформирующий агент, под воздействием которого ранее чувствительные к определенному антибиотику штаммы становятся устойчивыми к нему. Этим агентом являются ДНК, РНК, белки. referatwork.ru 1.Рациональная антибиотикотерапия. Побочное действие антибиотиков на организм человека и на микроорганизмы. Формирование антибиотико-резистентных и антибиотикозависимых форм бактерий.Рациональня а\бтерапия.- направлена на предупреждение резистентных форм, терапевтической концентрации. Минимальная ингибирующая концентрация/или мин подавляющая конц-это мин конц а/б, подавляющая рост бакт. Терминальная конц в 2-4 р больше. Меры борьбы направлены на получение резистентных видов: 1)новые гр или хим модификац а/б 2)нельзя использовать как крнсерванты 3)получ а/б, которые подавляют адгезию и ферменты бактериальной клетки 4)прицельная а/б терапия-определяет чувствительность штамма к а/б и лечат тем, к которые наиболее чувствительны 5)нельзя использовать в медецине-в ветеринарии 6)запрещается для профилактики. Побочное действие антибиотиков. Для макроорганизма: - токсическое действие; - дисбактериозы; - аллергические реакции; - иммунодепрессивное действие; - эндотоксический шок. Для микроорганизмов : - формирование атипичных форм микробов; - формирование антибиотикорезистентных и антибиотикозависимых форм микроорганизмов. 2.Реакция преципитации и ее разновидности. Механизм и методы постановки, практическое применение.Реакция преципитации и ее варианты. Сущность данной реакции состоит в осождение (прециnитации) антигена, находящегося в дисперсном коллоидном состоянии, воздействием специфических антител в растворе электролита. Механизмы реакций агглютинации и преципитации аналогичны и описываются теорией «решетки». Реакция преципитации является высокочувствительным тестом, так как позволяет обнаружить малые количества антигена или гаптена. Высокая чувствительность реакции преципитации позволяет использовать ее для выявления антигенов с помощью известных анти-сывороток. В одном из вариантов последовательные разведения антигена наслаивают на стандартное разведение диагностической сыворотки в пробирках, при этом осадок образуется в виде кольца на границе двух сред (кольцепреципитация). Реакцию оценивают по максимальному разведению антигена, при котором наблюдается кольцо преципитации визуально. Кроме того, помутнение может быть зафиксировано инструментальными методами - нефелометрией и др. Реакция преципитации применяется в лабораторной практике при диагностике инфекционных заболеваний, а также в судебной медицинской экспертизе для определения видовой принадлежности белков, в частности белков кровяных пятен, спермы, помощью этой реакции в санитарной практике определяют фальсификацию рыбных и мясных изделий. В биологии реакция преципитации используется становления степени ил филогенетического родства различных видов животных и растений. Иммунодиффузия. взаимодействие антигена с антителами происходит не жидкости, а в геле ИММ ноэлектрофорез (ИЭФ) представляет собой электрофореза в геле с иммунодифузией. Иммуноблотиг - один из современных высокоточных вариантов электрофореза- с анализом разделенных белков иммунологическим методом. Реакция Кумбса (антиглобулиновый тест.). Неполные антитела в отличие от нормальных моновалентны, поскольку они имеют один активный центр, способный взаимодействовать только с одним эпитопом: в то время как другие эпитопы остаются не связанными. В результате этого не происходит образования крупных комплексов, выпадающих в осадок в растворе электролита. Последние проявляются только в реакциях с бивалентными антителами. Для исправления этого положения вводится антиглобулиновая сыворотка (АГС), содержащая бивалентные антитела к глобулину, которая свяжет между собой моновалентные антитела, содержащиеся в исследуемом материале Таким образом про изойдет визуально видимая реакция гемагглютинации или агглютинация, свидетельствующая о наличии в исследуемой сыворотке неполных (моно валентных) антител. Например, в случае беременности резус-отрицательной женщины резус-положитель- плодом у нее в сыворотке крови появятся неполные антитела. Для их выявления в пробирку с исследуемой сывороткой крови вносят резус-положительные эритроциты, а затем АГС. Появление гемагглютинации свидетельствует о положительной реакции. 3.Стафилококки,классификация,характиристика биологических свойств. Токсины, ферменты патогенности. Заболевания вызванные стафилококками. Патогенез, эпидемиология, роль стафилококков в госпитальных инфекциях. Методы микробиологической диагностики стафилококковой инфекции, специфическая профилактика и терапия. Род стафилококки. к сем. микрококкоцеа. образуют капсулу. Элективная среда-молочно-солевой агар. Колонии гладкие, блестящие, без запаха, приподняты над агаром. Диф-диагн.ср.- с добавл. соли. Все Гр+ кокки, расположенные гроздьями. Факультативн анаэробы, на обычных питательных средах образуют пигмент: белый, золотист, лим-желт. хорошо растут на пит ср, содерж Nacl ,расщепляют многие углеводы. Факторы патогености: капсула, лейкоцидин, гемолизин, белок А, энтеротоксин, фибринолизин (растворяет фибрин, ограничивающий местн. восп. очаг), плазмокоагулаза (свертывание плазмы крови), гиалуронидаза (спос-ет распр-ю стаф. в тк. вследствие нарушения прониц-ти) лецитиназа (разруш.лецитин в составе клет.мембр. лейкоцитов), ДНКаза-имеет золотистый 1) ф-р колонизации: ф-т липаза- разр жирн к-ты ,способствует накоплению. 2)ф-р инвазии-гиалуронидаза, фибринолизин, плазмокоагулаза 3) факт защиты от фагоцитоза: микрокапсула, пептидогликан, тейхоевые к-ты, белок А 4) антилизоцимная акт-ть 5) факт,поврежд кл и тк: гемотоксин=гемолизин.Стаф энтеротоксиныA,B,C,D,E- накапл в продуктах и вызыв пищ отравлен(пищ токсикоз) 6)ф-р защиты от антимикр препаратов:ф-т беталактамаза.Эпид-я:Обнар-ся на коже и слиз.Резервуаром золот. Стаф. явл-ся здоровые носители и больные.Наиб. опасность предст. бактерионосители и больные с кожными поражениями. Стаф. резистентны к усл. ср.Стаф вызыв всевозм воспал проц: ранев инф,пневмония,бронхиты.пораж почек и мочепол сист и генерализ инф. менингит и сепсис. Имм-т после инф-ии недолг ,местн. Диагн: 1) иссл материал(гной) подверг. б/с иссл-ю и высевают на пит. ср.2) б/л:исслед мат-л кровь, мокрота, фекалии. После выделения чист.культ. опред. видов. принадл-ть. Для стаф.aureus-плазмокоагулаза, гемолизин и белокА. Фаготипирование для установления источника инф-ии. Также необходимо определение чувств-ти к ряду а/б. 3)серол прим редко Проф-ка: борьба с источн инф-ии, предупрежд забол в ЛУ. Леч-е: а/б (в-лактамные препараты), цефалоспорины, реже тетрациклины Билет№3 studfiles.net Занятие 4. Пояснения для студентов.
Контрольные вопросы.
Антагонизм микробов. Механизм антагонистического действия.В процессе эволюционного развития между определенными видами и группами микроорганизмов и другими живыми существами установились сложные взаимоотношения. В естественных условиях обитания (почве, воде, организме животных, на растениях) микробы находятся в ассоциациях – сложных обществах, состоящих из разнообразных видов бактерий, грибов, актиномицетов, простейших и других микроорганизмов. Биологическое явление, связанное с совместным существованием разнообразных видов в едином процессе, получило название симбиоза (сожительство). Формы симбиотических взаимоотношений, определившихся в результате длительного эволюционного развития, могут подвергаться изменениям вследствие смены условий окружающей среды. Иногда трудно определить, что приносит тот или иной симбиоз: пользу, или вред. Существующие формы симбиоза могут быть разделены на две группы: ассоциативные, благоприятствующие(симбиотические в узком смысле слова) иантагонистические(или конкурентные) взаимоотношения. Антагонистические взаимоотношения– такой вид симбиоза, при котором один микроорганизм оказывает неблагоприятное воздействие на другой; при этом микробы получают серьезные повреждения и даже гибнут. Повсюду, где обитают микроорганизмы, между ними идет непрерывная борьба за существование, за источник питания, за кислород воздуха, за место обитания. Это связано с образованием и выделением микробами-антагонистами метаболических продуктов, ингибирующих размножение некоторых микроорганизмов. К таким продуктам относятся органические кислоты, изменяющие рН среды, антибиотики, бактериоцины. По-видимому, в условиях, наиболее благоприятных для одного вида, другие всегда испытывают его антагонистическое отношение. Наибольшее число микробов-антагонистов обнаруживается в почве, особенно среди актиномицетов, грибов, спороносных бактерий, выявляются антагонисты и в водоемах (реки, озера). studfiles.net Механизмы действия антибиотиков на клеточные мишени
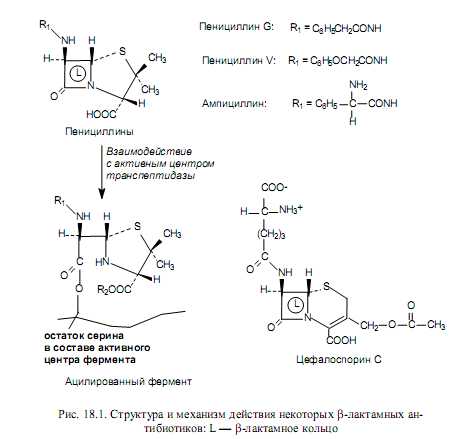
Ингибиторы синтеза клеточной стенки. Таким действием обладают b-лактамные антибиотики, к числу которых относятся пенициллины, цефалоспорины, нокардицин А, сульфазецин, тиенамицин и др. Все перечисленные соединения имеют в своем составе b-лактамное кольцо (рис. 18.1). Мишенью этих антибиотиков является бактериальный фермент гликопептидтранспептидаза, который катализирует формирование поперечных сшивок в молекуле муреина. b-Лактамные антибиотики имеют структурное сходство с фрагментом субстрата этого фермента (-D-Аla-D-Аla-OH) и связываются в активном центре транспептидазы таким образом, что b-лактамное кольцо оказывается в непосредственной близости от остатка серина. Гидроксильная группа серина участвует в формировании устойчивой ковалентной связи с атомом углерода нестабильного b-лактамного кольца (рис. 18.1). В результате образуется неактивная ацилированная форма транспептидазы, которая не способна катализировать реакцию транспептидирования (глава 14). Такое ингибирование фермента является необратимым, а действие антибиотиков носит бактерицидный характер: дефектная клеточная стенка не обладает должным запасом прочности и при увеличении клетки в процессе роста или осмотического поступления в нее воды разрушается. Кроме b-лактамных антибиотиков, нарушение процесса синтеза клеточных стенок бактерий вызывает полипептидный антибиотик бацитрацин А. Показано, что молекула бацитрацина может связывать в тройной комплекс с ионами двухвалентных металлов молекулу фосфорилированного липидного переносчика. В результате не происходит дефосфорилирование липидного переносчика, т. е. регенерация его свободной формы. В таком случае не могут осуществиться все стадии синтеза муреина, в которых задействован липидный переносчик, и не формируется клеточная стенка (бактерицидный эффект).
Следует добавить, что перечисленные антибиотики наиболее активны против грамположительных бактерий, поскольку именно их клеточные стенки содержат большое количество муреина. Для эукариот эти антибиотики малотоксичны, что объясняется отсутствием в их клетках основной мишени — ферментов и других компонентов синтеза муреина. Антибиотик циклосерин — производное аминокислоты серин подавляет активность двух ферментов, участвующих в синтезе муреина: аланинрацемазы и D-аланил-D-аланинсинтетазы. Он активен против широкого круга бактерий, малотоксичен, но у людей может вызывать расстройства нервной системы. Мембрано-активные антибиотики. Мишенью этих антибиотиков является, в первую очередь, плазматическая мембрана бактерий. Полимиксины (группа пептидных антибиотиков с циклолинейной структурой) способны связываться с фосфатными группами кардиолипина, фосфатидилэтаноламина и других кислых липидов, входящих в структуру липидного бислоя мембран. При этом наблюдается нарушение проницаемости мембраны — очень серьезное повреждение, влияющее на весь клеточный метаболизм (в первую очередь, происходит «потеря» ионов, создающих градиент на мембране). Кроме этого, полимиксины активируют фосфолипазы наружной мембраны грамотрицательных бактерий, что приводит к разрушению липидного бислоя. Эти нарушения носят бактерицидный характер, а действие полимиксинов направлено, в первую очередь, против грамотрицательных бактерий, обладающих дополнительной (наружной) мембраной. Похожим образом действуют на мембраны полиеновые антибиотики (амфотерицин В, нистатин, леворин, трихомицин). Их молекулы содержат сопряженную систему двойных связей, а мишенью действия является мембрана. Полиеновые антибиотики связываются со стеролами особой структуры, которые преобладают в мембранах грибов. В результате в мембранах образуются крупные поры, приводящие к нарушению проницаемости. Нарушают проницаемость мембран также антибиотики-ионофоры, описанные в главе 4. Ингибиторы трансляции. К этой группе относится значительное количество антибиотиков (рис. 18.2), среди которых наибольшее распространение имеют тетрациклины, аминогликозидные антибиотики (стрептомицин, канамицины, неомицины, гентамицины), хлорамфеникол, макролидные антибиотики (эритромицины, олеандомицин, лейкомицины, тилозин). Особенностью этих веществ является способность связываться с рибосомами, блокируя синтез белка. Следует отметить, что большинство перечисленных антибиотиков характеризуется избирательностью связывания именно с субъединицами (или их составными частями) 70S-рибосом, присутствующими в клетках прокариот. Поэтому данные антибиотики специфичны по отношению к прокариотам. Их действие носит в основном обратимый характер, и поэтому они обусловливают чаще бактериостатический эффект. Связываясь с рибосомами, ингибиторы трансляции либо препятствуют взаимодействию с рибосомами аминоацилтранспортных РНК (тетрациклины), либо ингибируют инициацию трансляции (стрепто-мицин), либо ингибируют активность пептидилтрансферазы — структур-ной части 50S-субъединицы рибосомы (хлорамфеникол), либо нарушают процесс транслокации рибосомы (эритромицин) и т. п. Антибиотик пуромицин имеет структурное сходство с концевым фрагментом акцепторной ветви аминоацил-тРНК, но он значительно меньших размеров. Благодаря этому пуромицин способен быстро связываться с А-участком рибосом (70S и 80S), однако после присоединения к аминогруппе пуромицина пептидного остатка (пептидилтрансферазная реакция) весь комплекс отщепляется от рибосомы из-за отсутствия кодон-антикодонового взаимодействия. Пуромицин обладает высокой токсичностью по отношению к эукариотическим клеткам, поскольку не имеет избирательности связывания с 70S-рибосомами. Этот антибиотик активен против бактерий, простейших, гельминтов, а также некоторых злокачественных опухолей.
Антибиотики-интеркаляторы. Действие этих антибиотиков основано на способности встраиваться (интеркалировать) в молекулы ДНК. Таким действием обладает, например, актиномицин D(рис. 18.2), адриамицин, дауномицин. Молекула актиномицина, в частности, встраивается своей плоской гетероциклической частью между параллельными плоскостями пар оснований ДНК. Подобным образом ведет себя дауномицин, две молекулы которого интеркалируют своими гетероциклическими ядрами между плоскостями пар оснований G/C. При таком воздействии локально нарушается структура ДНК, что приводит к ингибированию процессов репликации и транскрипции. Поскольку структура ДНК отличается высокой консервативностью, антибиотики-интеркаляторы активны и в отношении ДНК эукариот, что делает их высокотоксичными. Эти антибиотики находят применение при химиотерапии злокачественных опухолей, клетки которых, как известно, делятся быстрее нормальных, а значит, и матричные процессы, на которые воздействуют названные антибиотики, в них более активны. ДНК-тропные антибиотики. Эти антибиотики взаимодействуют с молекулами ДНК, приводя к их разрушению. Классическим примером служат митомицины (А, В, С), а также порфиромицин. Действие названных антибиотиков осуществляется двумя путями: во-первых, модификацией пуриновых оснований, во-вторых, формированием поперечных сшивок между антипараллельными цепями ДНК. Как результат, происходит подавление процесса репликации, возникают ошибки репликации, а также происходят разрывы молекулы ДНК. Еще один тип антибиотиков — блеомицины вызывают многочисленные одно- и двухнитевые разрывы в молекулах ДНК. Большинство ДНК-тропных антибиотиков высокотоксичны и используются в качестве противоопухолевых препаратов. Ингибиторы транскрипции. Кроме уже названных антибиотиковинтеркаляторов, транскрипцию подавляют рифамицины. Эти антибиотики взаимодействуют с ДНК-зависимыми РНК-полимеразами прокариот, в частности с b-субъединицей минифермента. Связывание носит нековалентный характер, однако оказывается довольно прочным, из-за чего нарушается процесс синтеза цепей РНК. Ингибиторы ферментативных процессов. В качестве таких антибиотиков выступают уже рассмотренные выше пенициллины, цефалоспорины, циклосерин, хлорамфеникол и др. Кроме того, следует отметить антимицин, подавляющий процесс транспорта электронов между цитохромами в дыхательной цепи, олигомицин, связывающийся с ферментами, обусловливающими сопряжение окисления субстратов с фосфорилированием, новобиоцин, являющийся ингибитором фермента ДНК-гиразы (принимает участие в репликации), актиномицин А, ингибирующий активность цитохром С-редуктазы.
Похожие статьи:poznayka.org 1. Антибиотики. История открытия. Классификация антибиотиков по способам получения, по происхождению, химическому строению, механизму действия, спектру антимикробного действия.первые химиотерапевтич ср-ва были синетз Эрлихом. Это были производные мышьяка- сальварсан и неосальварсан. Исследования, проведенные Эрлихом, позволили установить, что структурные особ-ти хим в-ва, напр, радикалы, определяют хар-р его противомикробного действия. В 1932 Домагк синтез первый сульфаниламидный препарат- стрептоцид , явившийся родоначальником многочисленной группы. В 1942 появ термин, кот стали обозначать образуемые разными м\о в-ва, способные подавлять разм-е и вызывать гибель определенных Классификация по способам получения и по происхождению: синтетич, полусиснтетич и биолог. По хим.составу 1)бета-лактамные (группа пенициллина, цефалоспорина) 2)тетрациклин 3)аминогликозиды (стрептомицин, аминогликозидные) 4)макролиды (эритромицин, олеандомицин) 5)левомицетин 6)рифамицины 7)полиеновые (нистатин, леворин). По мех-му антимикробного действия: на пептидогликан: кл-«мишенью» явл:1)ингибитор синтеза клеток, нарушающие пространственое расположение пептидогликана из-за блокады ф-та транспептидазы, блокирует синтеза предшественников пептидогликан. стенки-пенициллины, цефалоспорины 2)наруш ф-ций ЦМ -наруш осмотической резистентности (полиеновые, полимиксины), ингибир синтеза белка на рибосомах-блокада образ пептидных связей, вз-ия тРНК с комплексом рибосома-мРНК-амоногликозиды (тетрациклины, левомицетин,макролиды,) ингибированиеДНК-зависимой РНК-полимеразы (рифамицины). Выраженное избирательное действ на м\о опред антимикробн спектром. Одни преимущ на гр+ бакт. другие на гр-, третьи- на простейшие. Бактериостатическое действ-полное или частичное подавление роста, бактерицидное дейтвие-гибель. Действие А/Б измер в ЕД 2.Имуннологическая память, формы проявления, механизм. Роль иммунологической памяти в защите организма от инфекций. Использование феномена иммунологической памяти диагностики и профилактики инфекционных заболеваний. Иммунологическая память – часть Т- и В- сенсибилизированых, но не диффиренцируются, долго сохраняются в лимфотической ткани с памятью об Аг. При повторном попадании – вторичный иммунный ответ. Имм. толерантность – ареактивность ооганизма к определеному Аг, который в других ооганизмах или условиях имм. ответ. Толерантность к своим Аг может нарушаться при патологических процессах (аутоим. б-ни). 3. Вирусы гриппа, таксономия, общая характеристика, антигены, типы изменчивости. Эпидемиология и патогенез гриппа, лабораторная диагностика. Специфическая профилактика и терапия гриппа.ВИРУС ГРИППА (ORTOMIXOV) - сем, включает два рода: luenzavir: А и В., Ynbluenza. Морф: сферической, реже палочков и нитевидной, сост из сердцевины и наружней полипротеиновой Оболочки. РНК - однониточная, "-". К куриный эмбрион, к.к. Дрейф - изменяется часто. Эпидемиология: все возрасты в зимнее время. Патогенез: эпителиальная клетка слизистой оболочки верхних дыхательных путей - кровь - по организму, распад клеток - токсическое действие. инкубация - 1-2 суток, высокая температура, интоксикация, головная боль, боль в глазах. типо-, подтипо- и вариантоспец, обеспечивается клетками и гуморальный фактор защиты Ат класса ИГA. Лабораторная Диагностика. материал - мазки слизи, при летальном - кусочки легкого, мозга. выявл. Ат. - РИФ для выделения курином эмбрионе индикация при РГА. идентификация типовая - РСК, подтип - РТГА. Серод - РСК, РТГА, РН в к.к. р. прецип. в челе. ИФА. Спец. Профилактика: живая и инактивированая вакцина сохранена только гемаглютинин и нейромедиаза из трех типов - интраназ вакцинация. Низкий эффект связан с изменчивостью вируса. Лечение: химиотерапия противовирусные препараты (ремантифин, виразол, арбидол), интерферон и иммуномодуляры. противогрипп ИГ. Билет№10 studfiles.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |