|
|
||||||||||
|
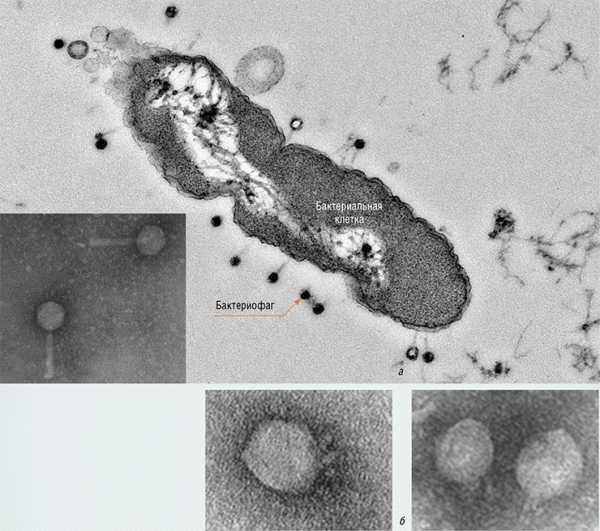
Глава 7. Бактериофаги и бактериофагия. Антибиотики и бактериофаги микробиологияБактериофаги – враги наших врагов: 22 Июл 2013 , «Но чтоб сие здание [Академия] непременно и полезно было, то имеет оное само себя править» , том 50, №2Бактериофаги – это вирусы, способные уничтожать бактерии. Основная роль в природе этих «пожирателей» наиболее многочисленных клеточных организмов на Земле заключается в существенном ускорении разложения органического вещества. Тем самым фаги, влияя на глобальные геохимические процессы, поддерживают круговорот вещества и энергии в биосфере Земли. Что касается человека, то поскольку многие из бактерий являются нашими врагами, кажется естественным использовать фаги в качестве эффективного и безопасного «биологического оружия» для уничтожения или контроля численности вредных и болезнетворных микроорганизмов. Наша страна была пионером фаготерапии, ставшей сегодня актуальным биомедицинским направлением. Первые отечественные фаговые препараты были разработаны в Тбилиси еще в 1930-е гг., а в настоящие дни они выпускаются в широком ассортименте. В отличие от обычных антибиотиков они обладают высокой избирательностью, не приводят к возникновению лекарственной устойчивости у патогенов и не имеют негативного побочного действия на организм больного. Однако их применение в клинической практике до сих пор ограничено в силу ряда объективных и субъективных причин, от противодействия крупных фармацевтических компаний до отсутствия квалифицированных специалистов и хорошо оборудованных микробиологических центров Бактериофаги (с древнегреч. – «пожирающие бактерии»), или просто фаги, – это вирусы, способные поражать бактерии. Согласно современным данным, основная роль в природе этих «убийц» бактерий, которые являются наиболее многочисленными клеточными организмами на Земле, заключается в существенном ускорении разложения органического вещества (в конечном счете до углекислого газа и воды). Тем самым фаги, влияя на глобальные геохимические процессы, поддерживают круговорот вещества и энергии в биосфере Земли. Что касается человека, то поскольку многие бактерии являются нашими врагами, кажется естественным использовать фаги в качестве эффективного и безопасного «биологического оружия» для уничтожения или контроля численности вредных и болезнетворных бактерий Бактериофаги обитают в почве (в 1 г – около 108 фагов), в реках, озерах и океанах (в 1 мл морской воды – 106 фагов), в других живых организмах (в желудочно-кишечном тракте человека – около 1012 фагов). Общая же численность бактериофагов, по оценке ученых, достигает астрономической цифры – 1031 фагов или 109 т вещества. Это своеобразная биологическая «темная материя», пронизывающая всю земную биосферу. Еще несколько цифр: если предположить, что средний диаметр фаговой частицы составляет 50 нм, то все бактериофаги планеты, построенные «в одну шеренгу», составят линию протяженностью 5*1020 км или 5*107 световых лет! Именно на таком расстоянии расположено ближайшее к нам скопление галактик в созвездии Девы, а до ближайшей звезды Проксима Центавра всего 4,2 световых года Как и все вирусы, бактериофаги находятся на границе между живым и неживым. Вне клеток-хозяев большинство фагов существует в виде вирионов – объектов, напоминающих сложные молекулярные кристаллы. А «живут» фаги, т. е. размножаются, только внутри бактериальных клеток, поскольку их генома недостаточно для автономного существования.
В 1915 г. англичанину В. Туорту и французу Ф. д’Эрелю удалось выделить эти агенты (впоследствии д’Эрелю пришлось многие годы бороться за свой приоритет с Туортом). Именно д’Эрель назвал вновь открытые частицы «бактериофагами». Он сразу понял, что они могут найти применение в качестве противобактериальных препаратов, и в 1919 г. впервые применил фаговый препарат для лечения дизентерии у детей Бактериофаги были открыты свыше ста лет назад в исследованиях, проводившихся в разных странах почти одновременно. Еще в конце XIX в. исследователи, в том числе российский микробиолог Н. Ф. Гамалея, обнаружили некие мельчайшие агенты, проходящие сквозь поры фарфоровых фильтров, которые были способны убивать бактерии. Мир бактериофагов весьма разнообразен: на сегодня известно более 500 разных видов фагов, отличающихся формой и строением. По отношению к бактериям фаги делятся на умеренные и литические. Умеренные фаги встраивают свой геном в геном бактерии, но проявляют свою «убийственную» активность не сразу: затаившись в нем, они размножаются вместе с бактериями и затем уничтожают их расплодившееся потомство. Лизирующие же фаги, заражая бактерию, сразу убивают ее. Именно такие простые фаги являются на сегодня наиболее привлекательными, с точки зрения использования в биотехнологиях и для терапевтических целей. Боевые «машины»Бактериофаги, эти настоящие природные боевые машины, устроены крайне просто: их генетический материал, ДНК или РНК, упакован в белковую оболочку, снабженную «орудиями» – специальными устройствами для нападения на бактерии.
Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс. пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы. ЧУДЕСА БАКТЕРИОФАГОВ Люди издавна сталкивались с чудесными случаями исцелений от инфекционных заболеваний. Сегодня мы имеем право считать, что зачастую их можно объяснить неосознанным использованием бактериофагов. Ведь эти бактерицидные агенты встречаются на Земле повсеместно – в почве и в воде, а для лечения воспалений и ран с древнейших времен применяли грязи и смеси на основе природных продуктов. Не исключено, что подобные случаи чудесного исцеления вызвали к жизни такие обряды, как омывание в священных водах Ганга и крещение в Иордане. Антибактериальную активность природных продуктов пытались использовать и не в столь далекие времена. В 1920-х гг. великий хирург-архиепископ Святитель Лука (Войно-Ясенецкий), находясь в ссылке в глухой деревне, узнал о местной знахарке, умеющей излечивать гнойные раны и чирьи с помощью смеси из земли, кислого молока и золы. Лука попытался разобраться в природе этого явления, экспериментируя с составом композиции. Однако результаты лечения плохо воспроизводились (впрочем, как и у всех работавших в то время с бактериофагами). Иногда оно приводило к фантастически быстрому излечению больных, иногда вовсе не помогало. Не имея необходимых условий для работы и возможности ознакомиться с медицинской литературой, Лука вынужден был оставить свои исследования. Сейчас мы знаем, что эффективность фагового препарата будет зависеть от того, имеются ли в его составе бактериофаги, «специализирующиеся» на патогенных бактериях конкретного пациента Люди издавна сталкивались с чудесными случаями исцелений от инфекционных заболеваний. Сегодня мы имеем право считать, что зачастую их можно объяснить неосознанным использованием бактериофагов. Ведь эти бактерицидные агенты встречаются на Земле повсеместно – в почве и в воде, а для лечения воспалений и ран с древнейших времен применяли грязи и смеси на основе природных продуктов. Не исключено, что подобные случаи чудесного исцеления вызвали к жизни такие обряды, как омывание в священных водах Ганга и крещение в Иордане. Антибактериальную активность природных продуктов пытались использовать и не в столь далекие времена. В 1920-х гг. великий хирург-архиепископ Святитель Лука (Войно-Ясенецкий), находясь в ссылке в глухой деревне, узнал о местной знахарке, умеющей излечивать гнойные раны и чирьи с помощью смеси из земли, кислого молока и золы. Лука попытался разобраться в природе этого явления, экспериментируя с составом композиции. Однако результаты лечения плохо воспроизводились (впрочем, как и у всех работавших в то время с бактериофагами). Иногда оно приводило к фантастически быстрому излечению больных, иногда вовсе не помогало. Не имея необходимых условий для работы и возможности ознакомиться с медицинской литературой, Лука вынужден был оставить свои исследования. Сейчас мы знаем, что эффективность фагового препарата будет зависеть от того, имеются ли в его составе бактериофаги, «специализирующиеся» на патогенных бактериях конкретного пациента
Лизирующий фаг своим видом больше всего напоминает космический корабль-робот, способный стыковаться с заданным объектом. К головке фага, представляющей собой белковый резервуар с упакованной в ней ДНК, присоединен «хвост» − белковая структура наподобие щупалец, на которых расположены так называемые узнающие элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии. После такой «стыковки» с бактерией-мишенью фаг прочно прилипает к ее поверхности. На одну бактериальную клетку могут одновременно напасть сотни бактериофагов, но чтобы убить ее, достаточно и одного. При этом взаимодействие фаг-клетка очень специфично: конкретный фаг может взаимодействовать лишь с определенными (целевыми) видами бактерий и не способен присоединяться к клеткам человека.
Когда фаг закрепится на поверхности бактерии, его «хвост» с помощью специальных белков внедряется в бактериальную стенку, протыкая ее. Сквозь хвостовой канал генетический материал фага вбрасывается в клетку. Генетические программы фага берут под контроль все жизнеобеспечение клетки: с этого момента все ее материальные и энергетические ресурсы, все молекулярные «машины» переключаются на синтез белков и копий генома фага. Бактерия обречена. В течение следующего получаса в клетке синтезируются сотни и тысячи новых фаговых частиц, после чего она разрушается, высвобождая очередной отряд бактериальных «убийц». Гонка вооруженийПо оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней. Удивительно, но зачастую бактериофаги убивают не все целевые бактерии. Так, из одного фекального образца можно высеять одновременно как живые бактериальные клетки, так и фаги, их инфицировавшие. Между тем в фекалиях человека концентрация бактерий составляет 105—108 КОЕ/г, что намного превышает концентрацию, необходимую для экспоненциального размножения фагов. Бактериофаг может очень эффективно убивать бактерии в культуре, но оказывается неспособен подавить их размножение в организме. Вероятно, имеется какой-то природный механизм, обеспечивающий одновременное сосуществование «охотников» и их «жертв» Но несмотря на такую высочайшую антибактериальную эффективность фагов, бактерии все же не исчезли с лица планеты. Дело в том, что в течение многих миллионов лет шла совместная эволюция этих организмов, которую было бы точнее назвать «гонкой вооружений». Благодаря мутациям фаги «изобретали» все новые средства и приемы ведения войны, а бактерии, в свою очередь, хитроумные средства защиты. Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.
Еще один защитный механизм бактерий – изменение поверхностных рецепторов: в этом случае фаг просто не может узнать «свою» бактерию. В ответ на это появляются фаги, несущие измененные узнающие элементы, которые способны связываться с новыми бактериальными рецепторами. Имеется несколько механизмов подобной модификации генетических программ у фагов и бактерий. Мутации могут возникать случайно, в ходе генетического копирования. Кроме того, с помощью рекомбинации (генетического перераспределения) разные виды фагов могут обмениваться фрагментами своего генома и даже захватывать фрагменты генома бактерий. К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками. Фаготерапия: сквозь тернииОткрытие вирусов, убивающих бактерии, дало начало новому способу контроля за численностью бактерий. Самое очевидное приложение – фаготерапия, применение бактериофагов для лечения бактериальных инфекций человека. Ее преимуществом является крайняя специфичность фагов, поражающих только «избранные» болезнетворные агенты. В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США. В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием. Так у Элиавы родилась мечта создать в Тбилиси мировой центр исследования бактериофагов. Эта идея заинтересовала И. В. Сталина, и в 1930 г. было построено и оснащено здание будущего Института бактериофагов, микробиологии и вирусологии, который сейчас носит имя его основателя. Однако далее события развивались по сценарию, характерному для СССР тех лет: в 1937 г. Элиава вместе с женой был арестован и расстрелян как «враг народа», а д’Эрель вернулся в Париж. Однако сам институт не погиб и продолжал успешно функционировать. С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами. Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal). Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком. Кстати сказать, в прекращении работ с бактериофагами за рубежом, помимо успеха антибиотиков, большую роль сыграл и политический аспект. Ведь фаговая терапия развивалась в СССР, и западным ученым было политически «неправильным» работать по тематике, связанной с именем Сталина. К тому же это были времена лысенковщины, когда западная наука воспринимала со скептицизмом все, что делалось советскими биологами. Коктейли из фаговНовый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год! ВОЗ предупреждает, что мир вскоре вступит в «постантибиотиковую» эру, когда лечить обычные бактериальные инфекции будет нечем. И на этом фоне фаготерапия выглядит весьма перспективным направлением, развитие которого может привести к созданию эффективных персонализированных методов лечения заболеваний. Для этого есть как необходимые знания о фагах и механизмах их взаимодействия с бактериальными клетками, так и технологии работы с вирусными агентами. Для фаговой терапии сегодня используют только вирулентные лизирующие фаги, в основном «хвостатые» фаги порядка Caudovirales, а также нитчатые фаги семейств Leviviridae (с одноцепочечным РНК-геномом) и Inoviridae (с одноцепочечным кольцевым ДНК-геномом). Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности. Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов. Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах. Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С. Современная историяК настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний. Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.
Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами. В качестве специфичных агентов, уничтожающих бактерии, бактериофаги сегодня находят применение в терапии заболеваний не только людей, но и животных, а также для защиты растений и при консервации пищевой продукции. Так, в 2006 г. FDA разрешила применение бактериофаговых коктейлей для обработки мясных и других сельскохозяйственных продуктов. В этом случае фаги получили статус пищевых добавок. Они также были разрешены к применению в качестве средства дезинфекции. Препараты фагов (в виде аэрозолей) были успешно испытаны в экспериментах по защите сельскохозяйственных птиц на крупных фермах, а также в рыбоводческих хозяйствах В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ. В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии. Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии. Поэтому лечение заинтересованных больных проводится в режиме медицинского туризма. Компания «Phage international» (Калифорния, США) направляет пациентов из разных стран, страдающих от хронических заболеваний, вызванных лекарственно устойчивыми бактериями, либо в Центр фаговой терапии в Тбилиси, либо в свою клинику в Мексике. Выбираем фагиПочему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам. Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР. Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании. Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами. Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами. Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными. Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.
Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов. АНТИБИОТИКИ Достоинства: широкий спектр действия; простота патентования Недостатки: разрушают собственную микрофлору организма, что создает угрозу вторичных инфекций; не способны концентрироваться в области инфекционного поражения; вызывают побочные эффекты: аллергии, кишечные расстройства и т. д.; приводят к возникновению бактериальных штаммов с лекарственной устойчивостью; создание новых антибиотиков – длительный и дорогостоящий процесс БАКТЕРИОФАГИ Достоинства: специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг; поиск нового фага занимает несколько дней или недель; производство недорогое и экологически чистое; не вызывают дисбактериоза; не токсичны и не вызывают побочных эффектов; после уничтожения патогенного агента элиминируются из организма Недостатки: слишком высокая избирательность – для гарантии успеха лечения нужно идентифицировать патоген; патентование затруднено из-за многообразия агентовУже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели. Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин. Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа. Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги? В России сегодня сложилась уникальная ситуация: фаговая терапия у нас разрешена, производится широкий ассортимент «индивидуальных» фаговых препаратов и фаговых коктейлей. Почему же их так редко применяют? Главным образом по причине уже упоминавшейся необходимости персонализированного подхода при фаготерапии. Ведь стандартные фаговые препараты не гарантируют результата, а если препарат не срабатывает, то это не только разочаровывает лечащего врача, но и в случае острого заболевания создает рискованную ситуацию для пациента. Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления. Литература Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011. Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15. Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215. Miedzybrodzki R., Borysowski J., Weber-Dabrowska B. et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121. Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451. Работа была поддержана АНО «Центром Новых Медицинских Технологий» в Академгородке (Новосибирск) : 22 Июл 2013 , «Но чтоб сие здание [Академия] непременно и полезно было, то имеет оное само себя править» , том 50, №2scfh.ru Глава 7. Бактериофаги и бактериофагияЯвление бактериофагии открыл и изучил французский микробиолог д'Эррель. В 1917 г. он наблюдал лизис культуры бактерий дизентерии после внесения в нее фильтрата испражнений больного, выздоравливающего от дизентерии. При многократных пассажах, то есть переносе из одной культуры в другую, фильтраты сохраняли свою лизирующую активность и даже усиливали ее. Ученый сделал из этого правильный вывод о том, что лизирующий агент - живой и при пассажах размножается в бактериях. Д'Эррель назвал этот агент бактериофагом (лат. phagos -пожирающий), а само явление лизиса - бактериофагией. Позже было подтверждено, что бактериофаг - живой. Это вирус бактерий, он размножается в бактериях, вызывая их лизис. Добавление бактериофага в культуру бактерий на жидкой питательной среде вызывает просветление среды. На плотных питательных средах при посеве смеси бактерий и бактериофага на фоне сплошного роста бактерий появляются стерильные пятна или негативные колонии фагов (рис. 8). Бактериофаг и специфичны, то есть лизируют определенные виды бактерий. Отсюда их названия: дизентерийный бактериофаг, стафилококковый бактериофаг. Обнаружены фаги не только бактерий, но и актиномицетов. В практической медицине бактериофаги нашли применение как лечебные и профилактические средства, Важное значение имеет то, что на примере бактериофагии были открыты и изучены многие проблемы общей вирусологиии и молекулярной генетики. Структура бактериофагов Размеры бактериофагов колеблются от 20 нм до 200 нм. Как все вирусы, содержат ДНК, или РНК, и белковый капсид. Чаще всего встречаются и лучше изучены бактериофаги, имеющие форму сперматозоида или головастика. Состоят они из головки, хвостового отростка, батальной пластинки с короткими шинами и хвостовыми нитями. Внутри головки располагается спирально скрученная пить ДНК, покрытая белковым капсидом. Хвостовой отросток - что полый цилиндрический стержень, окруженный сократительным чехлом. Базальная пластинка и нити осуществляют процесс адсорбции бактериофага на бактериальной клетке (рис. 9). Существуют бакте-риофаш. имеющие другое строение: с короткими отростком, с отростком без сократительного чехла, без отростка, нитевидной формы. Взаимодействие бактериофага с бактериальной клеткой Как все вирусы, бактериофаги не размножаются на питательных средах. Их размножение происходит только в чувствительных к ним бактериальных клетках, в процессе взаимодействия, в котором наблюдаются те же фазы, что при взаимодействии других вирусов с клеткой. Адсорбция бактериофага. Как все вирусы, фаги неподвижны, и столкновение с бактерией происходит случайно, затем адсорбция становится прочной, если у клетки имеются на поверхности фагос-пецифические рецепторы. Фаги, имеющие сократительный чехол, адсорбируются с помощью хвостового отростка. Внедрение фага внутрь клетки. Под действием фермента лизо-цима, который находится в хвостовом сегменте, в клеточной стенке бактерии образуется отверстие. Через это отверстие в результате сокращения хвостового чехла внутрь бактериальной клетки переходит ДНК фага. Белковый капсид остается снаружи. Синтез ДНК и белка бактериофага. В клетке прекращается синтез бактериальных белков. Образуются фаговые ДНК, а на рибосомах бактерий синтезируются молекулы фагового белка. Формирование фага. Сборка зрелых фагов из ДНК и капсида происходит в цитоплазме клетки. Выход зрелых фагов из клетки происходит при разрушении бактерий с помощью лизоцима, а затем зрелые фаги внедряются в новые клетки. "Урожай" фага, в зависимости от его вида, составляет от 20 до 200 частиц. Весь цикл взаимодействия, занимающий от 10 минут до нескольких часов, называется литическим циклом, а фаг при таком взаимодействии - вирулентным. В отличие от вирулентных, умеренные фаги не лизируют бактерии. Их геном, проникнув в клетку, встраивается в хромосому бактерии и в дальнейшем остается в хромосоме в виде профага и реплицируется вместе с ней. Бактерии, несущие профаг, называются лизогенными, а само явление - лизогенией. Лизогенные бактерии встречаются очень часто. Профаг, находясь в геноме бактерии, придает ей какие-либо новые свойства. Так, например, продукция экзотоксина у палочек дифтерии и ботулизма связана с наличием профага. В определенных условиях (воздействия температуры, химических веществ и др.) профаги могут превратиться в вирулентные бактериофаги. Размножаясь, они лизируют бактерии и могут переходить в другие бактериальные клетки. При выходе из хромосомы профаг может захватить соседние гены бактериальной хромосомы и при заражении другой бактерии, встроившись в ее хромосому, передать эти гены. Передача генетического материала от одной бактерии к другой с помощью умеренного бактериофага называется трансдукцией. Таким образом могут передаваться такие признаки, как устойчивость к антибиотикам, способность продуцировать какие-либо ферменты. Умеренные бактериофаги применяются в генетической инженерии в качестве вектора - переносчика генов. Практическое значение бактериофагов Препараты бактериофагов применяются для диагностики, профилактики и лечения. Фагодиагностика основана на специфичности бактериофагов: видоспецифические бактериофаги лизируют только определенные виды бактерий. Более того, бактерии одного и того же вида различаются по чувствительности к разным типовым бактериофагам, Таким образом можно с помощью набора типовых бактериофагов определять фаговары стафилококков, сальмонелл, вибрионов, Фаготипирование помогает установить источник инфекции и пути передачи. Лечебно-профилактическое действие фагов основано на их литической активности. Для получения препарата бактериофага культуру бактерий заражают бактериофагом. На следующий день лишрованную культуру фильтруют через бактериальный фильтр. К фильтрату в качестве консерванта добавляют хинозол. Для количественной характеристики бактериофагов используют такой критерий, как титр бактериофага. Титр фага можно выразить двумя показателями: 1) наибольшее разведение препарата, при котором бактериофаг лизирует соответствующие бактерии: 2) количество активных корпускул бактериофага в 1 мл препарата. Методы титрования бактериофага: 1) метод серийных разведении в пробирках с жидкой питательной средой по Аппсльману; 2) двуслойный агаровый метод, при котором подсчитывают число негативных колоний фага на фоне сплошного роста бактерий – метод Грациа. Готовый жидкий препарат бактериофага должен быть совершенно прозрачным. При кишечных инфекциях препарат применяют вместе с раствором питьевой соды, так как кислое содержимое желудка разрушает бактериофаг. Препараты некоторых бактериофагов для инъекций и местного применения выпускают в ампулах. Для приема внутрь препараты бактериофагов выпускаются также в виде таблеток с кислотоустойчивым покрытием, которое в щелочной среде тонкого кишечника растворяется. В качестве покрытия применяется пектин или ацетилфталилцеллюлоза (ЛФП). В нашей стране выпускаются препараты дизентерийного, сальмонсллезного, коли-протейпого, стафилококкового и других бактериофагов, а также наборы типовых фагов для фаготиинрования стафилококков, брюшнотифозных и других бактерий. studfiles.net АНТИБИОТИКИ, БАКТЕРИИ И ФАГИ | Наука и жизньПрошлое столетие писатели и публицисты окрестили веком атома, нейлона и пенициллина. Особенно большие ожидания вызвало открытие пенициллина; появившиеся вслед за ним аналогичные лекарства - их назвали антибиотиками - были способны защитить организм от атак, казалось бы, всех болезнетворных бактерий. Надежды на мирный атом и синтетические материалы в основном оправдываются. Расчеты на всемогущество антибиотиков, увы, тают с каждым годом: бактерии все успешнее сопротивляются антибиотикам, вырабатывая к ним устойчивость. Можно ли найти либо замену, либо союзников антибиотикам в борьбе с серьезными инфекциями? Да, можно. Это одноклеточные организмы - бактериофаги (с греческого - пожиратели бактерий). Недавно о них снова заговорили не только научно-популярные издания, но и научные, такие, например, как журнал "Science". Схема строения одного из видов бактериофага, поражающего кишечную палочку.  На рисунке показаны этапы внедрения фага в бактериальную клетку и ее разрушения. ‹ › ПОБЛЕКШИЙ СИМВОЛ Действительно, полвека назад антибиотики победно распространились по миру. Тогда казалось, что уже не нужны никакие другие средства, в том числе и бактериофаги, раз существуют надежные антибиотики. Вот как написано об этом в Большой советской энциклопедии, вышедшей в семидесятые годы прошлого века: "Антибиотики и другие химиотерапевтические средства оказались эффективнее фагов, в связи с чем их применение с лечебной целью сузилось". Сегодня в разных изданиях можно прочесть обратное: антибиотики, спасшие миллионы и миллионы человеческих жизней, теряют свою силу. Болезни все более упорно им сопротивляются: каждое новое поколение микробов накапливает устойчивость к этого рода лекарствам, вырабатывая своеобразный иммунитет. Не случайно в недавнем обращении Всемирной организации здравоохранения говорится, что прогресс в медицине будет сведен на нет, если не удастся найти лекарства, способные справиться с самыми устойчивыми носителями болезней. Науке известно примерно четыре тысячи антибиотиков, но лишь 60 из них широко применяются как лекарства. Три десятилетия назад, когда казалось, что с их помощью болезнетворные бактерии окончательно побеждены, дальнейший поиск природных антибиотиков шел уже не столь интенсивно. Правда, сегодня антибиотики создают и синтетическим путем - примером может служить синтезированный в последние годы "Линезолид", показавший себя с лучшей стороны при подавлении устойчивых бактерий. В частности, он уничтожает некоторые разновидности стафилококков - возбудителей воспалительно-гнойных заболеваний, против которых природные антибиотики бессильны. И тем не менее надежных лекарственных средств для борьбы с такими видами микробов, как энтерококки и стафилококки, так и не найдено. По данным врачебной статистики, от этих возбудителей серьезных инфекционных заболеваний и в наши дни погибает немало людей: только в США ежегодно от них умирают 14 000 человек. ВРАГ ТВОЕГО ВРАГА... Помните пословицу: "Враг твоего врага - твой друг"? Если врагами человека считать болезнетворные микробы, то, оказывается, у каждого из видов бактерий есть свой враг - фаг (его еще называют вирусом бактерий, поскольку он на них паразитирует). Он атакует бактерию, прикрепляется к ней, прокалывает ее оболочку и впускает внутрь свой генетический материал - действует, как всем знакомый шприц. Однако изучение под микроскопом строения одной из разновидностей фага, известного в медицине как Т2 кишечной палочки, показало, насколько природная конструкция превосходит шприц, созданный инженерами. Первое. Шприц вводится в тело с помощью длинной иглы. Фаг самостоятельно прикрепляется к бактерии множеством нитей и острыми зубцами, находящимися на его конце. Там же, на конце, расположена так называемая базальная пластинка, обеспечивающая плотное примыкание фага к бактерии S. Второе. У фага нет поршня, как у шприца, с помощью которого выдавливалось бы его содержимое в тело бактерии. Это делают белковые нити, подобные мышечным волокнам: сокращаясь, как пружинки, они заставляют молекулы ДНК покидать тело фага. Все это устройство укладывается в миллионные доли миллиметра. Форма фагов очень разнообразна - округлые, палочковидные, нитеподобные. Типичный фаг напоминает головастика. Но всех их объединяет суть воздействия на бактерию: ДНК фага, оказавшись в бактериальной клетке, подавляет ее ДНК. Происходит разрушение организма микроба, и из этих обломков фаг строит по плану, заложенному в его ДНК, свое потомство. Цикл размножения фагов внутри бактерии длится 30-40 минут. Таким образом умерший микроорганизм превращается в фабрику, производящую фаги, и на месте возбудителя болезни возникает сотня защитников заболевшего организма. Их присутствие в крови человека совершенно безвредно. Микробиология познакомилась с фагами в конце XIX века. В 1898 году русский ученый Н. Ф. Гамалея открыл вещества, вызывающие разрушение бактерий, - бактериолизины. Он и его сотрудники ставили опыты с носителями "сибирской язвы". Несомненно, Н. Ф. Гамалея имел дело с лизисом - распадом бактерий при действии на них веществ, содержащихся в цитоплазме бактериофага. Но у ученого тогда не было технического оснащения для детального раскрытия этого явления. Во времена Первой мировой войны канадскому исследователю Ф. Д'Эрелле и англичанину Ф. Туорту впервые удалось увидеть под микроскопом бактериофаги. Но детально изучать этих обитателей невидимого мира тогдашними методами было практически невозможно. Однако главную их особенность - "пожирать", а вернее - разрушать бактерии, ученые заметили. Именно поэтому в публикации об открытии Д'Эрелле дал им название "бактериофаги" - пожиратели бактерий. К тому же времени относятся и первые попытки применить их в медицине. Применение фагов в качестве лекарств врачи встретили с большим интересом. В тридцатых годах прошлого века американский концерн "Эли Лилли" основал даже клинику, где начали лечить фагами. Пропагандисты нового метода сулили исцеление от всех болезней. Однако действительность оставляла желать лучшего: научные основы такой терапии были еще так скудны, что новое средство применяли практически вслепую. Считалось, что все фаги одинаковы и побеждают любую бактерию. Одним и тем же бактериофагом начинали лечить разные заболевания, а болезнь все не уходила - так метод был серьезно скомпрометирован. Мнение о малой эффективности фагов задержалось в кругах медиков на многие годы, живет оно еще и сегодня. КАВКАЗСКАЯ НИТЬ ИССЛЕДОВАНИЯ В годы Первой мировой войны врачом на Трапезундский фронт (северо-восток Турции) попал грузинский биолог Г. Элиава. До него дошла информация об открытии Ф. Д'Эрелле, и он увлекся возможностями бактериофага как мощного оружия медицины. Г. Элиава и Ф. Д'Эрелле встречались после войны и вместе отстаивали взгляд на бактериофаг как на живое существо. Им противостояли сторонники неживой, кристаллический природы этих обитателей микромира - к неживым они относили и все вирусы. Этот спор ученых имел принципиальное, мировоззренческое значение. В нем решался вопрос: где наука должна провести границу между живой и неживой материей? В 1923 году Г. Элиава основал в Тбилиси Институт для изучения бактериофагов, благодаря которому нить исследования этих микроорганизмов, оборвавшаяся в западных лабораториях, здесь, на Кавказе, протянулась до наших дней. Усилиями энтузиастов, работающих в институте и сегодня, многое прояснилось в биологии фагов. Теперь новейшими исследованиями подтверждено, что фаги, уничтожающие бактерии, ближе к живому миру, нежели к неживому. Установлено, что разновидность фагов в микромире огромна и каждый из них способен умерщвлять только определенные виды бактерий. Для большинства микробов найдены "свои" бактериофаги, в том числе и для возбудителей болезней, сопротивляющихся антибиотикам. По сравнению с антибиотиками у фагов есть к тому же и определенные преимущества. Известно, что применение антибиотиков часто вызывает нежелательные побочные воздействия на организм человека, - иногда такие серьезные, как аллергия. Или другое осложнение: попадая в кишечник больного, антибиотики зачастую губят там всю микрофлору, вредную и полезную, тем самым открывая дорогу вредоносным микробам (недаром в последнее время такое распространение получил дисбактериоз). Фаги же убивают только определенные виды бактерий, не затрагивая жизнь нужной человеку микрофлоры. Второе достоинство фагов. Их действия в организме точно укладываются в тот срок, который необходим для уничтожения вторгшейся в него инфекции. С антибиотиками сложнее: врач должен сам определять курс приема лекарства, что не всегда просто. А фаги делают это автоматически. Они размножаются в организме больного за счет материала, взятого из тела бактерии (см. схему), которая ими атакована. Если в крови растет число возбудителей болезни, то и растет число фагов. Когда же такие бактерии уничтожены, воспроизводство фагов прекращается само по себе. С исследованиями, вот уже 70 лет ведущимися в тбилисском Институте имени Элиавы, сегодня знакомы и ученые на Западе. Американский микробиолог К. Мерилл в 1996 году ставил опыты на мышах, которым в лабораторных условиях вводилась смертельная доза салмонеллы - распространенного и опасного вида бактерий. С помощью фагов животные были спасены. Ученый и сегодня продолжает работать с фагами. В берлинском Институте имени Р. Коха в последние годы стали исследовать влияние фагов на ход излечения некоторых заболеваний внутренних органов человека. Руководитель этого направления Б. Аппель уверен, что именно фаги дадут "новую опору для лечения инфекционных болезней". Результаты, накопленные за десятилетия усилиями 250 преданных делу специалистов, дают грузинским микробиологам возможность продолжать работу, несмотря на сложности нынешнего существования института: государство прекратило финансирование, оборудование частью изношено, частью уже бездействует, штат сотрудников сократился в несколько раз. И тем не менее разработана композиция из пяти разновидностей штаммов фагов. Это "пожиратели" тех бактерий, которые, как правило, поселяются на обожженной коже. В отделениях больниц, где исцеляют ожоги, больше всего опасаются заражения обожженных мест стафилококками, что ведет к сепсису крови, который почти не поддается лечению. Теперь в Грузии создано лекарство "пирофаг" - надежный помощник именно в таких случаях. Оно составлено из смеси различных фагов. Гнойные раны, обработанные фаговым препаратом, излечиваются в течение 5-10 дней. Антибиотики, если и побеждают такие инфекции, то только в месячный срок. В холодильниках института хранится целый арсенал фагов - 3000 штаммов, способных встать на защиту здоровья человека. Раньше, до раздела СССР, институт был Всесоюзным центром фаготерапии. Из больниц, клиник всей страны сюда присылали образцы бактерий, с которыми было сложно справиться, либо вовсе незнакомых врачам микробов. В институте подбирали для неизвестной инфекции фаг, способный подавить ее. Если в институтском собрании фагов такой вид не находился, начинался поиск его в природе. И теперь ученые продолжают изыскивать фаги для разных случаев. (Один из сотрудников с гордостью сказал: "Мы вылечили английского посла!") Продажа лекарств - главный доход, позволяющий институту работать дальше. Здесь не страшатся будущего и верят в то, что их усилия успешно послужат медицине. *** В заключение - о появившейся недавно публикации исследователей из Рокфеллеровского университета в Нью-Йорке об успехах терапии с помощью фагов. Ученые нашли новый путь к уничтожению болезнетворных микробов. Главную роль в этом играет один из биологических катализаторов - лизин, получаемый из фагов. Лизин способен разрушать стенки клеток стафилококков, убивая тем не поддающуюся до сих пор стойкую бактерию. (К сожалению, американские ученые не вспомнили о работах русского ученого Н. Ф. Гамалеи, еще в конце XIX века открывшего свойство лизина разрушать бактерии, да и о многолетних работах тбилисского института.) Как уже говорилось, бактериофаги проникают внутрь бациллы и из "деталей" погибшей бактерии строят новые фаги. Этому молодому поколению фагов лизин также нужен, чтобы разрушить оболочку бактерии и выйти из нее. Новое, что отмечает работу ученых из Нью-Йорка, - они освободились от самого бактериофага, а действуют на носителя инфекции лишь лизином. Достаточно одной миллиардной части грамма этого вещества, чтобы в течение пяти секунд уничтожить культуру стафилококков. Мыши, которым ввели в кровь эти бактерии, через два часа после инъекции лизина были свободны от них. Исследователи надеются, что биокатализаторы помогут справиться даже с такими болезнями, как чума и туберкулез. А совсем недавно журнале "Sсience" опубликовал статью об успешной работе биологов из Техаса под руководством доктора Инг-Нанг Вонга. Его словами и завершим статью: "Бактериофаги - поистине золотая жила для создания белковых антибиотиков". www.nkj.ru 1. Методы культивирования бактериофагов. Роль фагов в микробиологии и медицине.Билет 41 Бактериофаги — вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их растворение (лизис). По механизму взаимодействия различают : Вирулентные фаги, проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Эти фаги адсорбируются на поверхности бактериальной клетки с помощью фибрилл хвостового отростка. В результате активации фагового фермента АТФазы происходит сокращение чехла хвостового отростка и внедрение стержня в клетку. В процессе «прокалывания» клеточной стенки бактерии принимает участие фермент лизоцим, находящийся на конце хвостового отростка. Вслед за этим ДНК фага, содержащаяся в головке, проходит через полость хвостового стержня и активно впрыскивается в цитоплазму клетки. Остальные структурные элементы фага (капсид и отросток) остаются вне клетки.После биосинтеза фаговых компонентов и их самосборки в бактериальной клетке накапливается до 200 новых фаговых частиц. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий. Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т. е. вести себя как вирулентный фаг, лизирующий бактерии. Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства. Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов. Практическое применение фагов. Бактериофаги используют в лабораторной диагностике инфекций при внутривидовой идентификации бактерий, т. е. определении фаговара (фаготипа). Для этого применяют метод фаготипирования, основанный на строгой специфичности действия фагов: на чашку с плотной питательной средой, засеянной «газоном» чистой культурой возбудителя, наносят капли различных диагностических типоспецифических фагов. Фаговар бактерии определяется тем типом фага, который вызвал ее лизис (образование стерильного пятна, «бляшки», или «негативной колонии», фага). Методику фаготипирования используют для выявления источника и путей распространения инфекции (эпидемиологическое маркирование). Выделение бактерий одного фаговара от разных больных указывает на общий источник их заражения. По содержанию бактериофагов в объектах окружающей среды (например, в воде) можно судить о присутствии в них соответствующих патогенных бактерий. Подобные исследования проводят при эпидемиологическом анализе вспышек инфекционных болезней. Фаги применяют также для лечения и профилактики ряда бактериальных инфекций. Производят брюшнотифозный, сальмонеллезный, дизентерийный, синегнойный, стафилококковый, стрептококковый фаги и комбинированные препараты (колипротейный, пиобактериофаги и др). Бактериофаги назначают по показаниям перорально, парентерально или местно в виде жидких, таблети-рованных форм, свечей или аэрозолей. Бактериофаги широко применяют в генной инженерии и биотехнологии в качестве векторов для получения рекомбинантных ДНК. studfiles.net |
г.Самара, ул. Димитрова 131 [email protected] |
 |